直接从原位样本中鉴定、分选和测序单个细胞对于深入分析微生物组的结构和功能具有巨大潜力。
在最新的一项研究中,基于用于细胞表型筛选的人工智能(AI)辅助对象检测模型和用于单细胞输出的跨界面接触方法,中国科学院的研究人员开发了一种名为 EasySort AUTO 的基于索引的自动化系统,其中对单个微生物细胞进行分类,然后将其包装在微滴中,并以精确索引的「单细胞单管」方式自动导出。基于 AI 辅助对象检测模型自动识别目标细胞,然后通过光镊调动目标细胞进行分选。
并且,该团队开发的跨界面接触微流控打印方法可以将细胞从芯片自动转移到管中,从而与后续的单细胞培养或测序相结合。单细胞打印系统的效率 >93%。单细胞打印系统的吞吐量约为 120 个细胞/小时。
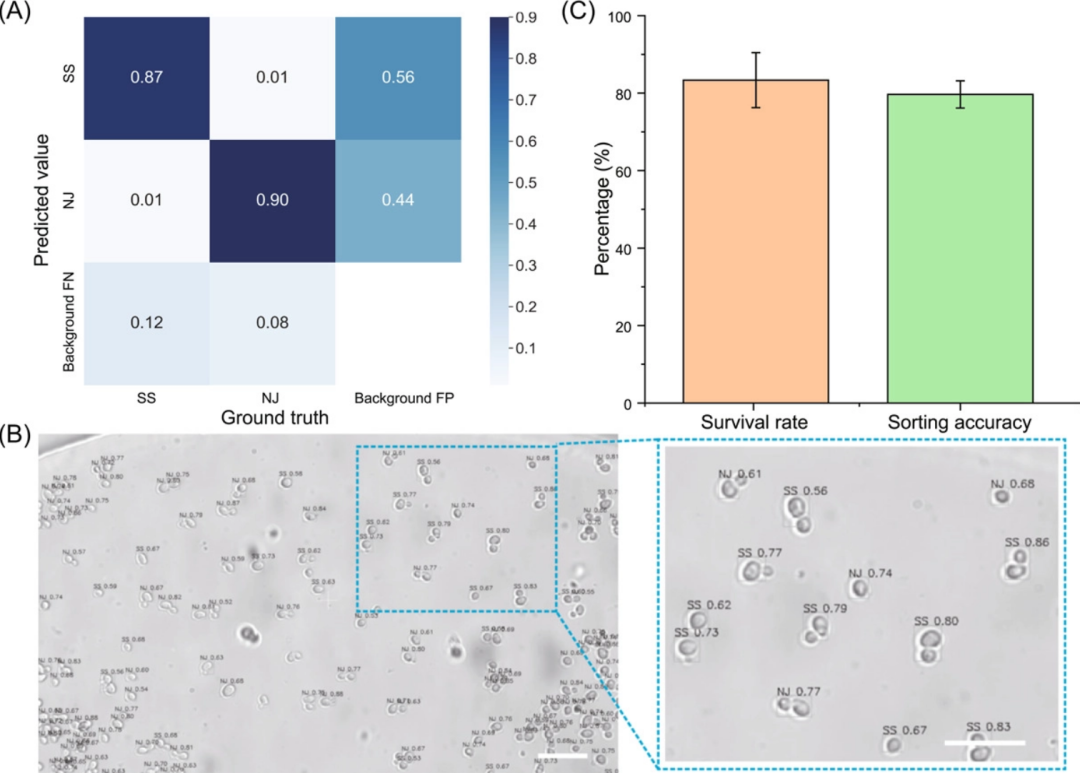
此外,酵母和大肠杆菌中 >80% 的单细胞都是可培养的,这表明在分选过程中可以更好地保存细胞活力。而且,AI 辅助目标检测支持从混合酵母样品中高精度自动分选目标细胞。EasySort AUTO 拥有自动化、指标维护、活力保存等特点,其在单细胞分选方面具有卓越的应用潜力。
该研究以「Artificial intelligence-assisted automatic and index-based microbial single-cell sorting system for One-Cell-One-Tube」为题,于 2022 年 12 月 18 日发布在《mLife》。

单细胞分析已成为生命科学的有力工具。从细胞群或细胞群中分离所需的单个细胞是单细胞分析的关键步骤。这个过程通常可以通过荧光激活细胞分选 (FACS) 来实现,并且当它直接从原位样本链接下游单细胞测序时,显示出深入分析微生物组结构和功能的巨大潜力。然而,当研究人员使用 FACS 系统以单细胞精度对细菌细胞(比典型人类细胞小 10 倍)进行分类时,操作通常很复杂且成本要求很高。
此外,FACS 系统通常无法以基于索引的「所见即所得」方式对细胞进行分选,同时保持高度活力。尽管将光学系统与 DEP 耦合的介电泳 (DEP) 阵列策略可以实现可靠的单细胞识别和分选,但对于微生物细胞的单细胞分选极具挑战性。因此,一个简单的、基于指标的、保持活力的单细胞分选系统对于微生物组的单细胞分析具有很高的价值。
微流体为这个问题提供了一个有前途的解决方案。微流控系统可以根据图像、荧光信号或拉曼光谱识别细胞,并通过DEP、重力、离心力、光镊或声波进一步分选目标细胞。然而,分选的细胞通常需要从芯片中冲洗出来以进行进一步的组学分析,这需要新的工具来精确分配目标细胞以桥接单细胞多组学。明场、荧光或拉曼显微光谱的图像包含丰富的表型信息以指导细胞分选。基于图像的细胞分选是一种高分辨率和无标记的检测方法,允许直接从原始样本中进行单细胞分选。
中科院的研究人员开发了一种拉曼激活的重力驱动单细胞封装(RAGE)系统,其中通过单细胞拉曼光谱(SCRS)筛选细胞,然后以精确索引的「One-Cell-One-Tube(OCOT)」方式获得目标微生物单细胞,以保持其活力(在基于拉曼的分选的情况下)。然而,在微通道中保持水相静态是一项繁琐的操作,这对于单细胞捕获和封装的高精度非常重要。
为了简化操作,该团队近期又开发了一种光学镊子辅助池筛选和单细胞分离 (OPSI) 系统,用于精确、索引地分离单个细菌、酵母或人类癌细胞。然而,细胞的实时成像、分选和导出仍然需要繁琐的人工操作。为了解决这些问题,需要解决两个问题:(i)细胞检测和分选仍然依赖人工选择和操作;(ii)目标细胞需要从芯片中手动导出。
人工智能 (AI) 是一种很有前途的图像分析工具,因为它能够检测隐藏在细胞图像中的固有细胞特性以进行细胞识别。例如,可以基于明场显微镜图像以单细胞分辨率直接识别感染疟疾的血液样本中的细胞种类和阶段。因此,人工智能辅助目标检测模型具有实现细胞自动识别和分类的潜力。在单细胞自动导出方面引入类喷墨打印、微流控冲击打印、DEP阵列等策略;然而,这些策略需要复杂的芯片制造或外部控制设备,这显著增加了仪器开发的难度和使用成本。因此,仍然需要开发一种自动化且低成本的单细胞导出方法。
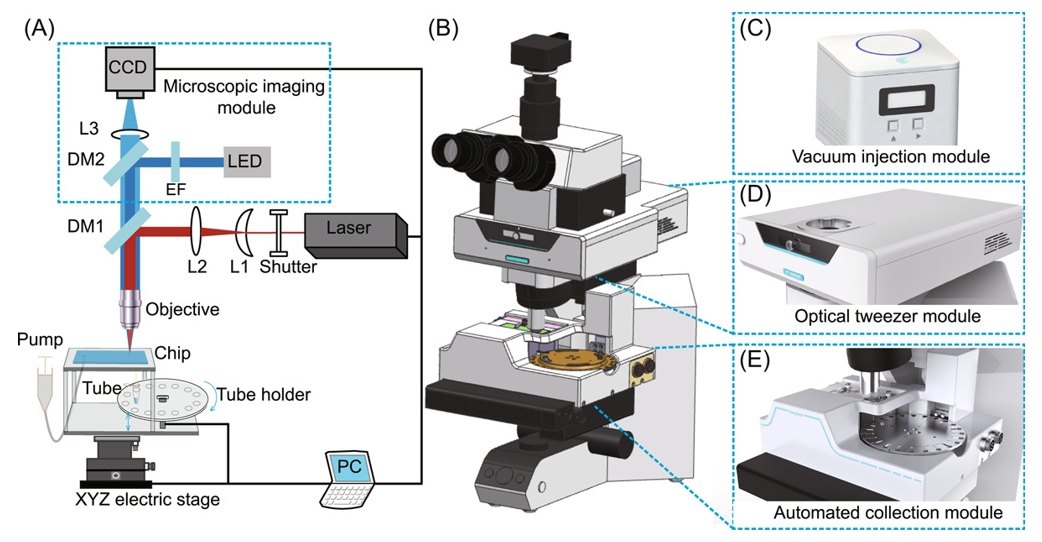
图示:EasySort AUTO 系统概览。(来源:论文)
在这项工作中,该团队使用用于细胞表型筛选的 AI 辅助对象检测模型和用于单细胞输出的跨界面接触方法,开发了一个名为 EasySort AUTO 的自动和基于索引的系统,其中对单个微生物细胞进行分类,然后打包成微滴并以精确索引的「OCOT」方式自动导出。在该系统中,微流控芯片设计有用于细胞检测和识别的微室和用于自动单细胞输出的毛细管。AI辅助目标检测模型实现了对微腔内混合样本目标细胞的高精度识别。系统集成的光镊模块允许以无损伤和高操作分辨率精确移动尺寸范围为 1 至 30μm 的细胞。单细胞采集模块能够将细胞从芯片自动转移到试管中,从而很容易与后续的单细胞培养或测序相结合。
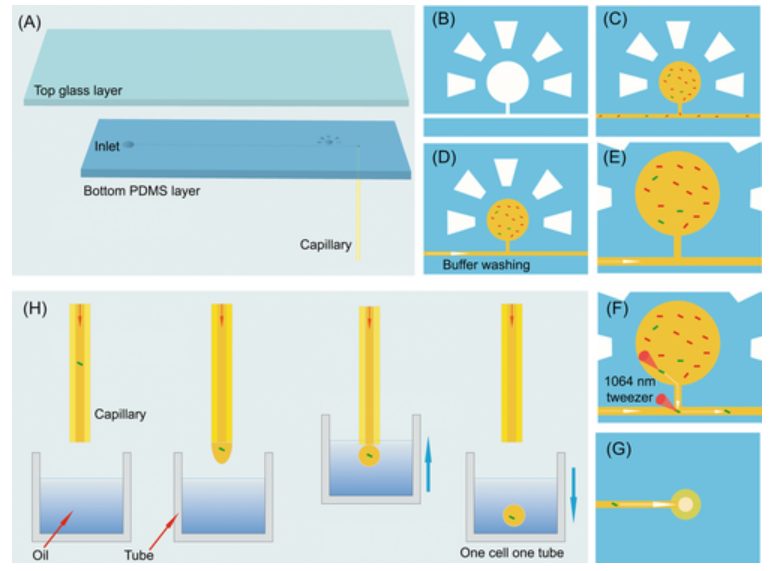
图示:EasySort AUTO AI辅助单细胞自动分选打印流程方案。(来源:论文)
人工智能算法与传统图像识别算法的主要区别在于它使用卷积核和反向传播自动提取特征。AI辅助单细胞分选系统可实现从混合样本中自动识别目标细胞。AI 辅助细胞识别取代人工选择,实现细胞自动识别。集成的 1064nm 光镊实现了 1–30µm 的宽尺寸范围内的细胞分选。
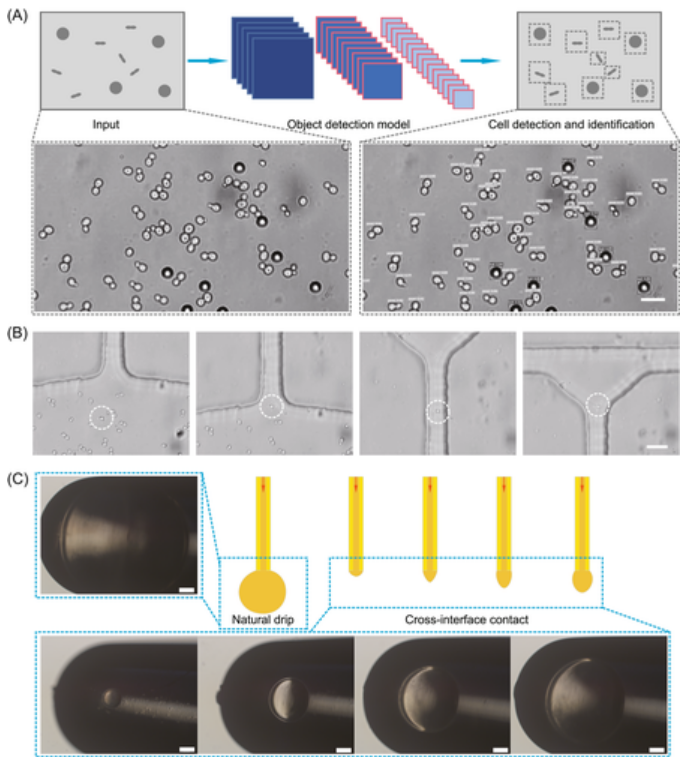
图示:EasySort AUTO 中的自动单细胞分选。(来源:论文)
此外,在微室中进行静态细胞成像的策略(不限制成像询问时间)对于从高度异质性样品中精确而大规模地并行筛选那些稀有靶细胞尤为重要和可取。同时,交叉界面接触方法可以将芯片内的细胞自动转移到宏观管中。研究表明,酵母和大肠杆菌的 >80% 的单细胞在这种分类后是可培养的,表明在分类中更好地保存细胞活力。另外,AI 辅助目标检测支持从混合酵母样本中自动、高精度地分选目标细胞,这一点研究人员已通过下游单细胞增殖分析得到证实。
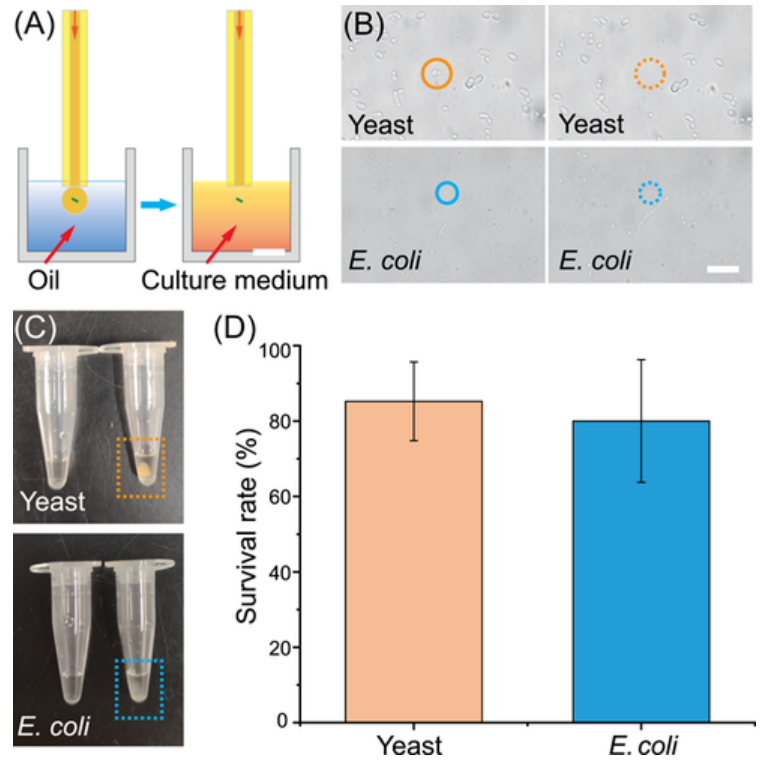
图示:单细胞打印与单细胞增殖试验相结合。(来源:论文)
FACS 可用于基于图像、荧光、散射光和非常高通量的微生物鉴定。然而,FACS 需要昂贵的设备、专业的人工操作和繁琐的样品制备来保证实验结果的准确性,这对一般实验者进行单细胞分选具有挑战性。相比之下,EasySort AUTO 系统的模块化设计和与光场、荧光或拉曼光谱仪耦合的多功能性将大大提高微生物单细胞组学对小型实验室的可及性。
尽管如此,FACS 分选细胞的生存能力可能会受到多种仪器因素的负面影响,例如分选过程中的机械和生理应力,从而使所需细胞的恢复变得困难。相比之下,EasySort AUTO 分选的细胞保持了出色的细胞活力保存。值得注意的是,当系统对小型细菌进行自动图像识别时,如果细胞不靠近焦平面,则可能无法检测到一部分细菌细胞。这可以通过设计更小的室深芯片,来提高非常小的微生物细胞的视觉清晰度或通过集成额外的聚焦机制来解决。此外,当系统执行目标单元格的自动移动时,路线上的非目标单元格可能会干扰目标单元格的移动。为了解决这个问题,研究人员需要开发一种考虑这种可能性的路径规划算法。
目前用于单细胞打印的 EasySort AUTO 系统的吞吐量约为 120 个细胞/小时。使用光镊进行细胞操作的速度慢和自动单细胞输出效率低是两个主要的限制因素。对于前者,可以提高平台的移动速度和激光强度,以确保光镊能够持续快速地操作细胞。对于后者,虽然跨界面接触法需要非常简单的设备来实现单细胞液滴输出,但系统自动采集模块的低移动速度限制了单细胞采集的速度。为了提高通量,该团队正在开发一种具有更高收集速度和准确性的新型三维移动平台,用于自动化单细胞收集。
EasySort AUTO 系统代表了一种用于微生物单细胞分选的自动化、基于索引和活力保存的解决方案。虽然该团队已经通过两种菌株的混合证明了基于图像的微生物筛选的适应性,但是基于图像的微生物筛选的应用仍然受到限制,因为相同的细菌菌株可以具有不同的大小和形状,而不同的微生物也可能具有非常相似的大小和形状。
在使用 AI 辅助图像识别算法进行图像识别时,样本来源和成像质量都会影响识别的准确性。本质上还需要稳定和显著的视觉差异,因此 AI 算法可以提取以进行识别。基于图像的微生物筛选的广泛应用需要开发更清晰的微生物图像相机和更智能的 AI 辅助图像识别算法,这仍然具有挑战性。另外,系统提供的基于荧光的分选可以结合荧光原位杂交(FISH)等荧光标记方法进行下游基因组分析,以获得微生物分类学和功能信息。值得注意的是,该系统有可能与拉曼光谱仪结合用于单细胞分选,这将大大拓宽该系统的应用。该系统拥有将表型与基因型联系起来的能力,这为进一步的单细胞分析提供了十分方便的工具。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/mlf2.12047
相关报道:https://phys.org/news/2022-12-ai-image-recognition-automatic-identification.html
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢