2023 年 6 月 10 日,智源大会第二天,智源大会地址:https://2023.baai.ac.cn/
诺贝尔化学奖得主Arieh Warshel在静明厅给观众带来了题为“Multl Scale and Artificlalintelligence Studies of Enzymes”的精彩讲座。Arieh Warshel教授是在生物化学领域取得重要突破的科学家。在本次演讲中,Arieh Warshel教授对其近年来的工作进行了梳理,其工作通过模拟和人工智能的结合,揭示了酶催化的机制,并成功地设计出了更高效的酶和具有特定选择性的药物。

Arieh Warshel介绍:
2013年诺贝尔化学奖得主,美国国家科学院院士。1966年,以优异成绩获得化学学士学位后,他赴以色列威兹曼科学院继续深造,并在那里取得了化学物理学的硕士、博士学位。随后的几年,他回到威兹曼科学院任职副教授,也是担任英国剑桥MRC分子生物学实验室的一名EMBO研究员。1976年,他加入南加大化学系,至今仍是化学和生物化学杰出教授和Dana and David Dornsife讲席教授。

Arieh Warshel:
本讲座将讨论有关酶的人工智能研究中的多尺度问题。我在博士期间,通过li Sikuo的实验和理论结果,用了一些人工智能的方法。
主题:对酶进行建模的不同方法
本讲座的主要内容将涉及不同方法对酶进行建模。酶可以比溶液中相应的反应快得多地进行化学反应。酶是非凡的催化剂。它们有时会加速反应速率高达10的20次方。但这相对于水中的相应化学反应而言。它们主要是通过使活化能,即打破键的能量壁垒,比溶液中的相同壁垒要低得多来实现的。因此,本讲座将重点关注使用计算机进行理解,然后尝试设计酶的方法。
通过量子力学和分子力学结合对酶进行物理建模
现在,在分子层面上的理解需要计算机,因为我们有一个由许多原子组成的复杂系统。在原子层面上,很难通过实验加以证明,因此我们设计了一种方法来解决这个问题。在这里,我列出了不同类型的酶。基本上,任何生物体内高能壁垒的系统都受到酶的调控。对酶进行物理建模的主要方法是将量子力学和分子力学相结合。其中化学部分由量子力学和量子化学建模,系统的其余部分由分子力学建模,即使用电荷和不同残基上的静电作用的弹簧模型。
现在,有很多实施量子力学/分子力学方法的方式,你必须考虑速度和准确性,特别是当你想处理大量的序列空间时,你需要能够在计算机上进行处理。目前我们最喜欢的方法,也是最强大的方法,就是所谓的EVB方法,基本上描述了化学反应在不同状态之间的转变,这些状态是通过一个混合项进行混合的,该混合项是根据实验进行拟合的。
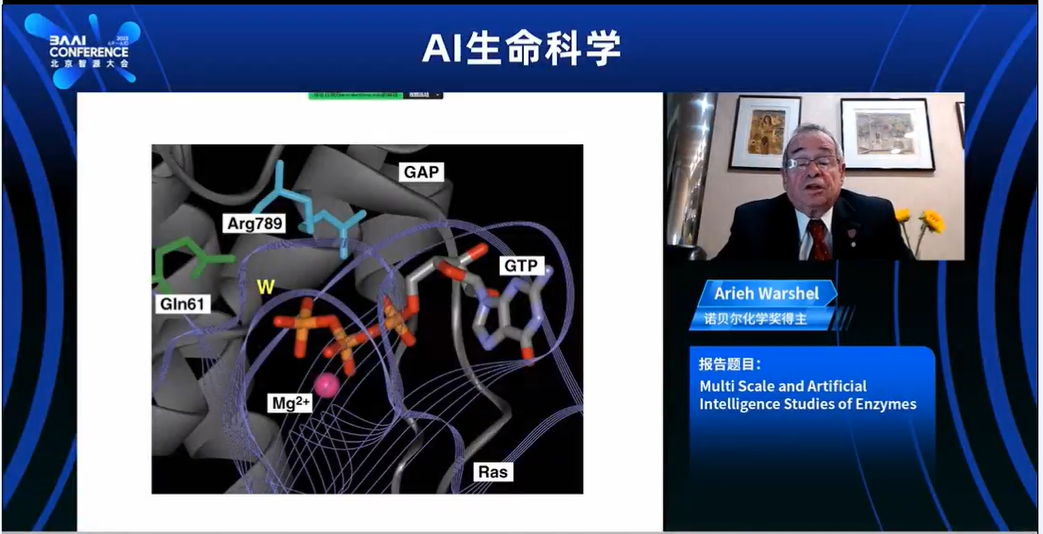
例如,在对神经氨酸酶的反应进行建模时,我们通过两个状态来对其进行建模,这两个状态基本上是两个假场。然后我们通过一个混合项将它们混合,以在溶液中重现能量学。然后我们通过改变环境与这两个状态的相互作用来转移到酶中。这种方法非常强大。我只是要展示一下我们进行研究的标准演示,当我们尝试研究与单个事务控制相关的G14类似物与控制GTP到GTP plus first fart的断裂时,这是一个非常复杂的化学反应。
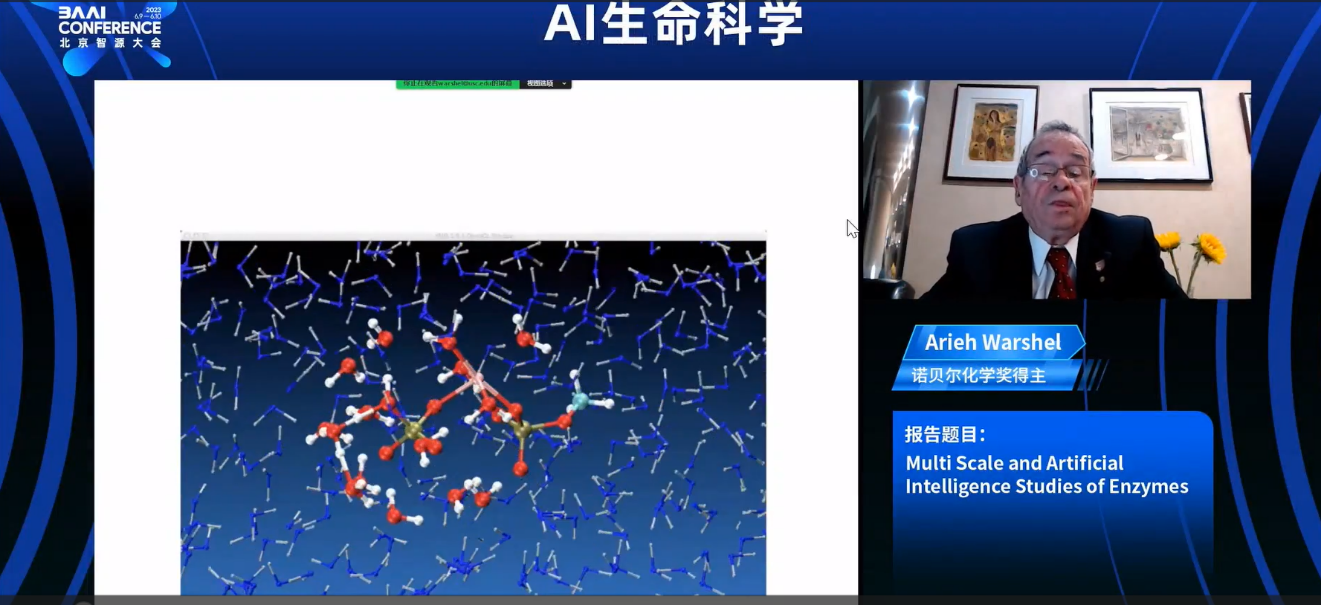
在这里,你可以看到GTP和绿色的镁离子。你研究了势能面,当你获得足够的知识后,你将在酶中使用相同的势能面,用代表酶的原子取代水分子。这是一个典型的模拟。水分子攻击第一个基团。绿色的原子是镁离子,最终键被打破。因此,你可以模拟这个过程的动力学。但你真正想做的是模拟能量学,因为活化能决定了整体速率。这里是用代表酶的原子进行研究这个gap系统的示例。这使得反应变得快速。通过对导致癌症的不同突变体进行研究。
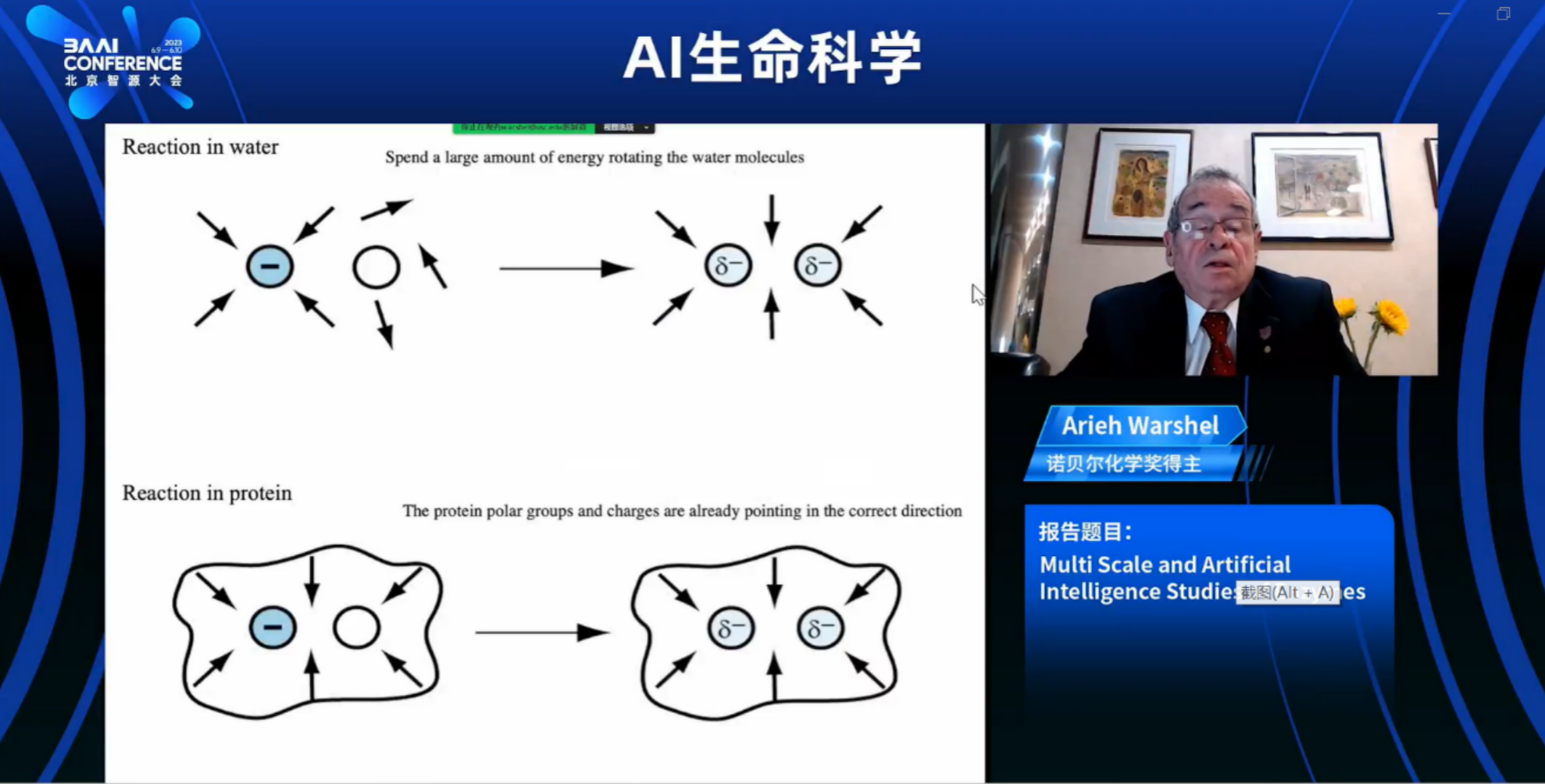
通过这种方法,我们研究了无数的酶。我们能够模拟水中反应与酶中反应之间的差异。这基本上从70年代末开始,并且从80年代初以来变得更加定量。我们得出的结论是,我们检查的任何情况下,催化作用都是由过渡态的静电稳定性引起的。这不是简单的静电作用。它实际上改变了所谓的重排能。因为当你在水中进行化学反应时,例如,在两个反应中,离子移动到另一侧,溶剂分子必须重新排列。这与所谓的重排能有关。你必须支付这种偶极重排所需的能量。另一方面,在一个良好的酶中,环境部分已经朝着正确的方向定向,你不需要支付重排能。
如何设计酶?
在我们研究的大多数情况下,我们能够证明这是催化作用的起源。这是一个并不简单的概念,在生物化学界,有些人仍然没有完全接受它。但这是计算所发现的,也是合乎常理的。因此,现在我们转向本讲座的主要部分,即我们能否利用我们的知识不仅理解生物化学,而且设计酶?部分原因是人们对设计更感兴趣,因为它可以预测某些东西。
因此,我们尝试看看是否可以以一种可预测的方式改变酶。如果你只是随机进行尝试,那么可能有无数种可能性,就像我们之前提到的20的300次方。这不是想要的方向。现在,这在基因编辑中可能非常有用,如果你能够控制那里工作的酶,并控制提供的选择。当然,还涉及许多技术问题。
因此,通过理解酶的机制和反应动力学,我们可以尝试设计新的酶,以实现特定的功能。这对于开发新的生物催化剂、药物研发和其他生物技术应用具有潜在的重要意义。当然,这个领域还存在许多挑战和限制,但随着计算能力的提升和更深入的研究,我们可以希望在酶设计方面取得更大的进展。
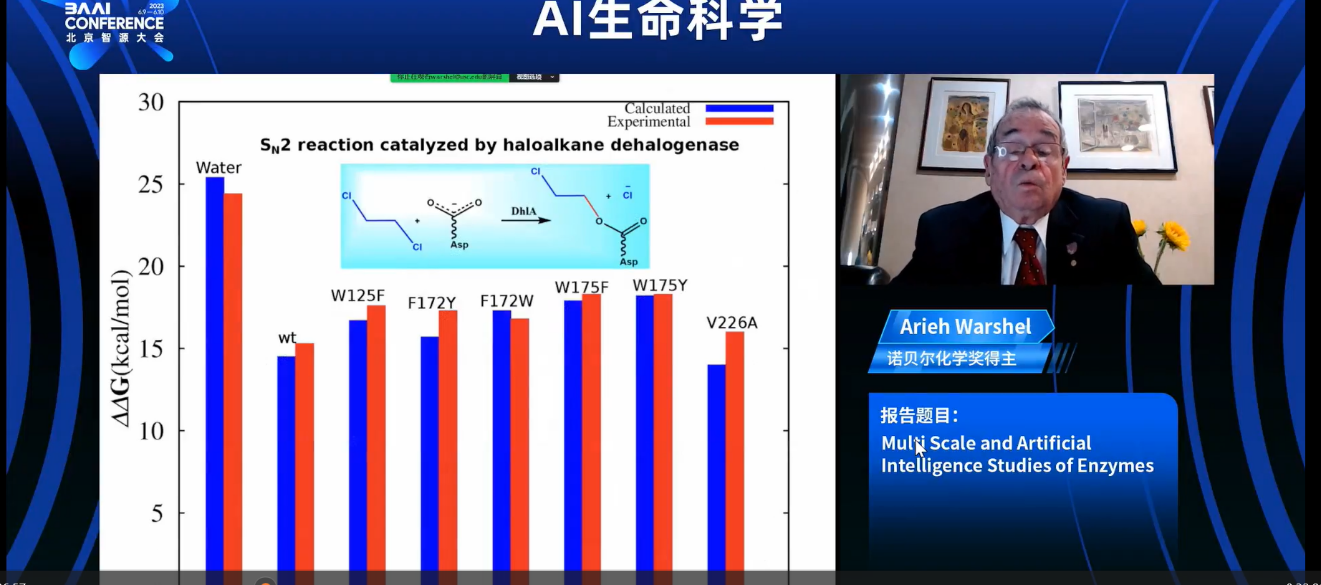
我们能采取什么行动呢?有两种方法。一种是定向进化,基本上是模仿进化的过程。它尝试让系统随机突变,并每次选择一个更快的酶作为新一代。如果你有物理学背景,你希望能够预测这种变化。当然,这是一个非常非常困难的挑战。所以我们希望能够准确地预测突变的效果。原则上,如果你想遵循物理原理,你可以使用QM/MM方法。意思是,你可以通过自由能扰动将一个氨基酸残基突变为另一个,这在计算机上非常容易。但这并不能保证结果是正确的。存在着收敛和其他问题。所以你必须检查你的计算结果与实验的吻合程度。

现在,当我们检查非突变体和相对简单的突变体,比如这个例子中的酶,我们似乎在预测突变的影响方面做得相对不错。我们对于解决的一个关键挑战是研究肯普消除酶(kemp eliminase),这是一种人工合成的酶,被用于酶设计中的竞争性试验平台,不同的研究人员竞相提出酶设计的优化方案。这个酶最初是一个非常糟糕的酶,所以改进它可能并不是那么困难。
首先,我们研究了一代代的突变体,这些突变体是通过下游蛋白质工程方法产生的。我们发现这种酶反应速度更快,与通常试图使过渡态更极性的天然酶不同。本质上,该酶使用一种非常简单且不太普遍的策略来不稳定化基态,这一策略使用了一个离子化的谷氨酸残基,从而使得方向反应加快。这是一种非常糟糕的策略,进化并不使用它。在后续的一代突变体中,唐·希尔伯特(Don Hilbert)通过稳定过渡态做得更好。我们能够重现这两个现象并理解它们的原因,虽然我们没有预测到它们,但我们重现了已知的情况。基本上,我们产生了不同的突变体。我们是否能够理解或与定向进化竞争?我们选择了唐·希尔伯特通过主要步骤在定向进化中设计的酶进行研究,这些步骤涉及多个氨基酸残基的改变。
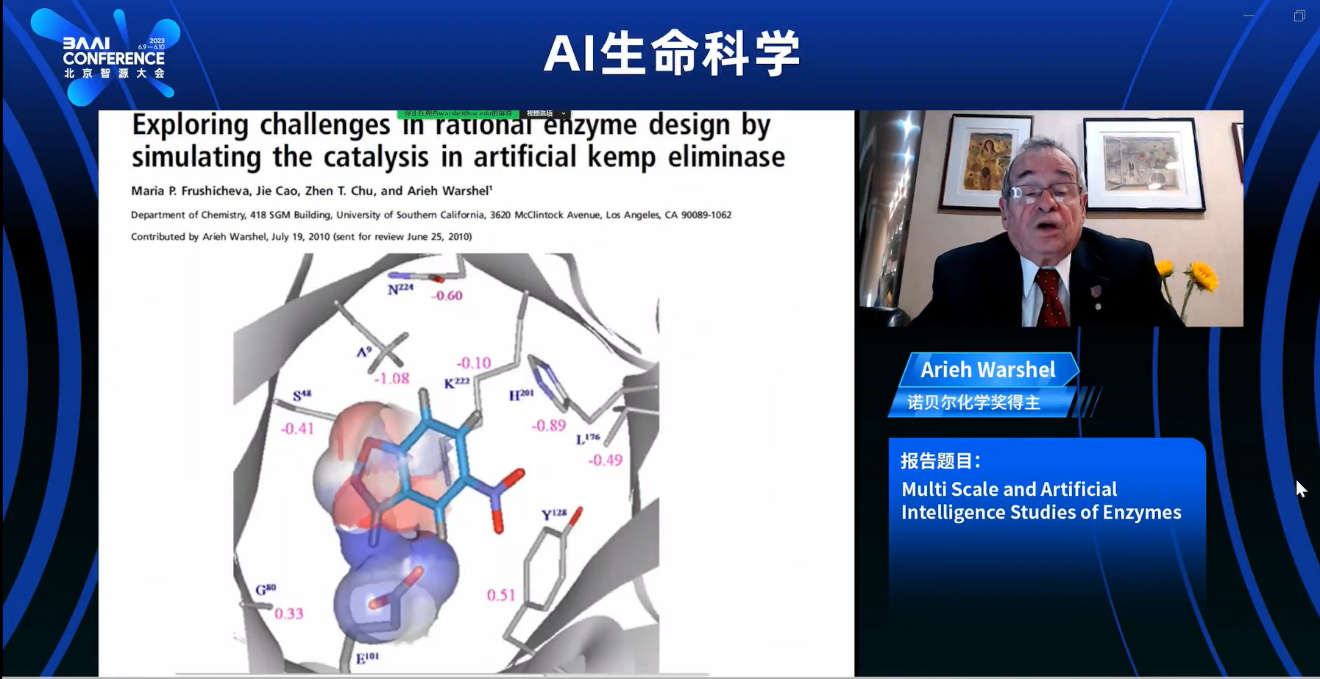
首先,当我们知道不同步骤的结构时,我们取得了非常好的成果。但是,当我们试图从一个结构转变到另一个结构时,我们遇到了困难,基本上碰到了瓶颈,一直失败。因此,我们决定进行大规模筛选。我们产生了大量的突变体,并允许它们进行松弛和旋转。我们在每种情况下都观察了激活能垒,从某种程度上可以说我们做得还可以,因为我们排名最低的垒高突变体是最好的,但仍然不够好。
利用人工智能的方法获得更好的突变体
我们决定尝试从人工智能获得帮助。我们试图观察结果并找到如何获得更好的突变体的方法,我们在几个系统中进行了研究。
首先是酶催化剂。这是我们的主要研究对象,然后是一些关于抑制剂的研究,以及关于发光细胞的研究。首先,在酶中,我们试图通过使用某种人工智能的筛选方法来获得更好的酶。我们有一个线索,因为人们使用最大熵方法来寻找适应性。基本上,它是通过最大熵来评估我们任务的整体适应性,我一直对酶设计和酶催化剂非常着迷。我们尝试的是与一般适应性问题相反,我们能在催化剂方面做些什么?我们在信息中没有使用关于催化剂的任何知识。因此,这种方法相对奇怪。我们不关注许多催化剂,因为许多系统都还不为人所知,而是关注整体的群体相互作用,我们可以通过最大熵来评估,也可以通过其他方法来实现。
那么,推动这个项目的是谁呢?其计算了许多酶的最大熵,并开始寻找与最大熵相关的能量之间的奇怪相关性。
我们从喜欢这个开始,并发现了计算的最大熵与进化需要和蛋白质折叠稳定性等方面的能量之间存在着显著的相关性。我们发现了一种引人注目的相关性,即酶变得更加稳定时,催化能力增强。我稍后会详细讨论这个方向。
然后,我们开始系统地进行研究。我们再次使用了另一个例子,发现了相当好的相关性,也在逐渐向好的方向发展。接着,我们在DNA上进行了类似的研究,也发现了良好的相关性。总体而言,我们得到了一个非常密集且稳定的关系图,显示了k cat 和有时是k cat /K m 与最大熵能量之间的关系。稍后我们将讨论这意味着什么,但在所有黄色部分,相关性都是负相关的。
研究人员试图通过模拟进化过程和利用人工智能方法来改进酶的性能。他们发现了最大熵计算与酶稳定性和催化能力之间的相关性,并进行了系统的研究。虽然他们在预测突变效果方面取得了一些成功,但他们仍在努力解决相关挑战,并寻求进一步的改进。
现在,如果存在这种相关性,你可以利用它来尝试设计酶。你只需沿着这条线前进,试着转移到具有更高最大熵的序列,以获得更高的催化剂。因此,我们对突变进行了一次选择。印度在Republic of July成立了一个挖掘实验小组。Bimboskey正在努力工作,因为在这种情况下,雷达芜杂状态下,我们感兴趣的确切决定步骤并非完全是反应的决定步骤,我们感兴趣的是关键步骤。
我们确实建立了最大熵与催化剂之间的相关性。然后,我们决定尝试设计类似于Kemp消除酶的人工酶。在这里,我们发现了另一种情况。我们发现,稳定性越高,酶的催化反应速度越快,这是稳定性与活性之间的反向关系。这是我在1978年就已经考虑过的问题,因为如果你想要重新组织活性位点,就必须通过折叠能量来付出代价。实际上,在这些图表中,一个方向是催化剂,另一个方向是稳定性。通过减少稳定性来增加催化剂。然而,这只发生在靠近活性位点的区域,在远离活性位点时情况就会改变。
人们试图通过改变远离活性位点的基团来尝试改变催化剂。在dell,相关性如下,酶越不稳定,催化剂越快。我们提出的一个非常重要的观点是,当你想要改善催化剂时,你首先必须寻找与活性位点不太远的基团的相关性。当我们继续研究的下一个系统是荧光素酶,它类似于萤火虫和其他系统。它是一种生物发光酶,具有广泛的生物技术和其他行业应用,我们希望提高其效率。因此,我们进行了大量的实验尝试,同时也进行了一些理论研究,并借助人工智能进行计算。我们分别研究了催化中心和酶表面,并发现催化中心与最大熵之间有着非常有希望的相关性,相关性达到了0.69,而对于表面相关性则稍逊一些。这是另一个我们尝试研究如何产生不同颜色的案例,虽然相关性略低,但我们首次尝试的主要目标是获得更活跃的荧光素酶。在图表中,你可以看到我们有两个坐标轴,一个是改进效率,另一个是改进稳定性,这主要通过处理表面来实现。当然,我们也可以尝试改变颜色,我们也进行了尝试。我们得到了一些显著的结果,其中几个我们预测的突变体实验上表现比野生型酶更有效。
对于从头设计酶的人来说,这可能并不令人印象深刻
我们选择了唐·希尔伯特通过主要步骤在定向进化中设计的酶进行研究,这些步骤涉及多个氨基酸残基的改变。
,因为最初的酶是一种糟糕的酶。但是在这里,我们有一种经过极长时间的进化循环设计出来的酶,我们成功地实现了比野生型酶更好的效果,这可能是第一次或其中一次。而这仅仅是通过最大熵的简单计算,并选择提高催化剂的趋势。我们也进行了稳定性的研究,并取得了比野生型酶更好的结果。所以,这是一个非常简单的方法,但却取得了令人鼓舞的成果。
最后一个系统是药物设计,主要是共价药物。如果你了解慈善机构对信号传导的控制,你会知道这是一个非常庞大的产业。他们做得很出色,但问题在于选择性。你可能会找到一个很好的药物来阻断或激活信号传导,但它并不具有选择性,因为所有这些信号传导机制非常相似。

因此,如果你为某种信号传导机制找到了一种良好的药物,有个问题是它也会阻断你不想处理的信号,这就是所示的情况。你希望寻找选择性。我们主要关注的一个系统是一种针对BTK的共价抑制剂,它涉及到白血病和其他问题。我们想要找到针对它的特异性抑制剂。我们试图寻找不同的电荷元素,并对选择性进行研究。最终,我们得到了选择性和抑制的关系表格。我们发现,通过某些突变体,我们获得了非常高的选择性。我们试图理解发生了什么。我们得出结论,我们正在处理的是一种不可逆的抑制剂,并试图理解它的速度受到何种控制。
这需要进行QM/Mm EVB计算,它可以显示与巨大的放出能力结合的结合力有多强。常规的共价抑制剂动力学规律并不适用。因此,我们必须模拟抑制时间,以更好地理解控制这些抑制剂的因素,并可能找到改进的方法。
总结一下,我们结合了基于物理的多尺度建模方法来理解催化过程,但我们发现使用人工智能可以极大地推进研究。我们发现了计算最大熵的有趣相关性,甚至在不考虑催化过程的情况下,并将其与催化剂相关联。我们根据这种相关性设计了新的突变体。

Q&A
Yi Qin:
我有几个问题。从一个您在早期发现的问题开始,实际上从上世纪70年代末开始,您已经确认如果蛋白质的部分区域与催化位点相关联,那么它们将更有可能对催化起作用。
Arieh Warshel: 不,我从未发现过。他们从未找到过。实际上,我发现这是不正确的。
Yi Qin: 但是根据最大熵理论,您也确认了,在接近催化位点的某些区域确实有贡献,而当它们远离时,实际上它们的贡献非常小。这实际上与我们刚才说的您从未发现的情况一致,但其他人声称他们已经发现了。但我想知道是否有办法使用人工智能从序列上预测某些修复试验是否会对催化起作用。
Arieh Warshel:我不会在这里进行反动力学的演讲,因为它很长。但你看,有运动。植物试图做的事情本质上是在反应期间最小化运动,以及在过渡态运动期间的输出运动。但它们比相应的运动要小得多。你会在溶液中进行化学反应吗?所以,再次说,如果有人问我为什么我认为它有效,我会告诉你另一件事,但我不能看出任何相关性,如果你最终找到了它,探索其存在的原因将是重要的。
Yi Qin: 我知道关于动力学效应对催化作用的讨论已经进行了很长时间。但正如你所说的,这可能是一个持久的讨论。我有另一个问题,可能会更简短。根据您的分析,您设计了比野生型酶更高效的酶。而且似乎适用于不同类别的酶。现在是否有关于最大熵方法适用于哪种类型的酶的预测,或者是否还有其他因素需要考虑?
Arieh Warshel:
所以我的答案将会有一个,我想展示一下这个景观,并告诉你我认为正在发生的事情。这是我的观点,这不是文俊的观点,但我相信或者我认为我们在这里发现了一种非常高效的插值方法,即如果我们以更大的最大熵来绘制这个景观,这实际上是一种稳定性,当你改变稳定性时,催化剂往往会改变。这确实是我们的主要贡献。它并不总是清楚改变的方向,但你倾向于改变。
现在,如果你按照不同酶的稳定性来追踪这个景观,很可能如果你再走几步,你仍然会在同一个山谷中。所以我再次认为,我没有展示这种方法是普遍适用的,我们基本上找到了一种非常好的工作,一种很好的插值方式。最大熵实际上是一种非常有效的预测稳定性的方式,因为它确实关注蛋白质群之间的相互作用。并且稳定性与催化剂相关。所以我认为这就是正在发生的事情。我们还不确定,我们正在学习它,但就像我们在露西亚案例中所做的那样,我们目前对独特性的了解还很少,我们尚未对化学反应进行建模,只进行了光谱学研究。但它仍然非常有效。
MC:
我欣赏您从第一原理和人工智能的组合中获得的模拟结果,这种组合非常强大。从这些模拟中得出的洞察,关于酶是如何工作的,关于如何降低酶与底物结合的自由能的传统模型说法是,酶的功能是降低酶和底物复合物的自由能,对吗?
那么,从这个模拟中,这个图景是否仍然基本正确?您是否看到与这种非常重要且可能大部分正确的对酶如何工作的理解有任何偏差?这可能与这个问题有关。
Arieh Warshel: 答案是,嗯,霍林是一个巨人,因为没有结构,他无法理解酶是如何工作的。尽管将减少活化值归功于他,这是正确的,但他并没有提出一个基于空间排斥的模型,这会破坏基态稳定性。最重要的是,他从未能提出酶是如何降低活化能的解释。而我们的模拟结果显示,这是通过静电效应实现的。与大多数生物化学家争论的认为是通过破坏基态稳定性来实现的。所以我认为模拟对于解释酶如何催化反应有很大帮助。
另外,史蒂夫·博克斯的优秀工作进一步支持了这一点,这与霍林的论点几乎没有关系。任何模拟都能够很好地帮助我们理解酶如何催化反应。但这在某种程度上比预测突变的小效应要容易。所以我认为我们对酶为何如此高效的理解非常透彻。但要将这种理解转化为残基对残基的影响,比如通过改变20个残基的一个残基,这并不简单。
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢