

今年5月,同宜医药宣布完成近1亿美元的B轮和B+轮融资,B轮融资由惠每资本领投,园丰资本、农银国际、一村资本、通和毓承等跟投,B+轮融资由盛迪投资领投,上海联和投资、合肥产投、合肥高投以及苏州工业园区科创基金等跟投。
资料显示,同宜医药成立于2016年,是一家领先的双靶向配体偶联药物Bi-XDC创新药企,聚焦全球首创(First in class)新药,已有三款癌症治疗产品进入临床试验阶段。
公司创始人、董事长兼CEO黄保华博士有二十多年的丰富药物研发经验及海外大型企业高层管理、商务开拓和创业经验,曾在雅培、安进(Tularik)、Millipore、Applied Biosystems、Abgent任博士后、实验室主任、商务拓展高级总监、总裁等职务,是一位药物设计专家和连续创业的企业家。
需要强调的是,B+轮领投机构盛迪投资是恒瑞旗下的产业基金,盛迪投资表示将发挥产业基金资源优势,支持同宜医药的Bi-XDC技术平台在其他方向上的拓展。
作为中国医药巨头,恒瑞医药常被人称为“医药一哥”,2021年公司市值曾一度突破6000亿元,2019-2023连续5年入选美国《制药经理人》杂志评选的全球制药企业50强榜单,曾创下了全球排名第32的中国药企最佳成绩。
作为国内最早一批布局创新药的企业,恒瑞医药在重视内部研发的同时(2022年公司研发投入超8.9亿美元),也积极对外投资,于2022年设立上海盛迪生物医药私募投资基金合伙企业,目前该平台已投资项目包括瑞宏迪医药和同宜医药,前者是一家基因治疗公司。
被“一哥”青睐,同宜医药究竟有何过人之处?
 跨界人生:从实验室到谈判桌再到创业者
跨界人生:从实验室到谈判桌再到创业者
1987年,在北京大学完成化学专业本硕学业的黄保华,出于对生命科学的浓厚兴趣,选择出国深造,赴美国俄亥俄州立大学攻读生物化学博士。
对于此时的黄保华而言,新药研发是一个新鲜事物,为了近距离接触,他在博士毕业后去了当时在雅培工作的Stephen W. Fesik的实验室做博士后研究,作为业界大牛,Stephen W. Fesik提出了以片段为基础的药物设计,开启了一个全新的领域。
在雅培实验室的那段日子,黄保华取得了许多研究成果,并在《自然》及其子刊上发表了多篇文章,师从世界一流的导师和团队,为黄保华之后的人生积累了宝贵财富。
不过,与学术研究相比,天生喜爱尝试和挑战的黄保华更喜欢深入药物研发的一线,他进入了一家创新药初创公司Tularik(后于2004年被安进斥资13亿美元收购),创办了该公司片段药物设计实验室。
回想起这段经历,他表示那四年的历练“让我对新药研发的全流程,尤其是早期研发有了更全面、系统地了解,同时也使我萌生了以后进行创业的想法。”
离开Tularik,黄保华继续拓展着自己的能力圈,在获得康奈尔大学的MBA学位后,他进入了Upstate USA,在这家致力于细胞信号产品的公司负责商务拓展业务,此后又分别在Millipore和Applied Biosystems(两家均为知名的生物制药技术、服务提供商)任商务合作和企业战略的总监,之后又成为抗体制造商Abgent的总裁。
可以说,在雅培和Tularik的七年时光里,黄保华积累了药物创新研发的经验。而在随后的近十年经历中,他又在生物制药产业尤其是CRO行业里建立起深厚的人脉和资源。

图:同宜医药创始人、董事长兼CEO黄保华
黄保华曾说:“我之前所做的所有努力和准备,都是在为自己的创业梦想做铺垫”,现在看来,在多个领域摸爬滚打过来的他,万事俱备,只欠一个契机。
最终让他迈出创业第一步的,就是ADC(抗体偶联药物)的东风。
2011年,武田制药和Seagen联合开发的Adcetris获FDA批准上市,获得了全球首款第二代ADC、全球首款批准用于一线治疗的ADC、自1977年以来首个获批用于治疗HL的新药等多项突破,给整个创新药行业带来震撼,引起了黄保华的格外关注。
在此前的研发项目中,难成药成为困扰黄保华的心魔,而ADC的出现,让他看到了希望:偶联技术也许会让许多不可成药的分子具有成药性,这意味着自己创业的时机已到。
同年,黄保华在中美两地创立了宜百奥和iBIOSOURCE,专注于ADC中间体及多肽药物开发CRO服务,成为国内最早入局ADC的创业者之一。
而在2011~2013年,国内除了恒瑞、齐鲁、荣昌、科伦等大药企外,鲜有初创企业涉足ADC,相关投融资更是基本为零,没有外部资本支持的黄保华,选择卖掉位于上海的房子来创业。
在无人问津的岁月里,黄保华团队扎扎实实地建立技术竞争力,五年时间里,一家创新药公司初具雏形。
2016年,同宜医药正式成立,并获得通和毓承的A轮融资。
两年后,公司产品进入临床,其研发的1.1类新药CBP-1008获得中国NMPA临床试验批准开展临床I期研究。
2020年,CBP-1008获得美国FDA临床许可,同宜医药在美国的分公司创立。
随着公司的快速发展,黄保华意识到管理团队也需要扩张,他请来了自己的大学同学和雅培的老同事邵军博士助阵,现任公司首席技术官的邵军博士曾就职于海正药业、扬子江药业、恒瑞医药、宝洁、雅培等国内外知名药企,拥有25年以上的多肽药物研发、生产管理及药政注册经验。
此外,首席运营官严明明于2021年加入公司,先后在阿斯利康、罗氏、雅培、西安杨森、开拓药业等国内外药企担任商务副总裁,事业部总经理,战略联盟负责人等多个管理职位,具备丰富的业务拓展的经验;首席医学官滕燕曾在在解放军总医院(301医院)工作10年以上,并在辉瑞、百时美施贵宝、诺华、赛诺菲等公司工作20余年,在肿瘤、血液、免疫的等领域拥有深厚的药品开发、临床研究能力。
目前,同宜医药的团队已经超过百人,位于苏州工业园区生物医药产业园的新药研发中心占地3600平米,在中国、美国、欧洲和澳大利亚进行临床开发及合作。
 进攻难成药靶点
进攻难成药靶点
需要强调的是,同宜医药并非一家传统的ADC初创,从技术和管线来看,公司是一家以PDC为基础、辐射整个XDC(偶联药物)乃至PROTAC(蛋白水解靶向嵌合体)药物的生物科技公司。
近年来ADC药物的火热带动了整个偶联药物的发展,包括PDC(多肽偶联药物)、RDC(核素偶联药物)、SMDC(小分子偶联药物)、AOC(抗体寡核苷酸偶联物)、ADeC(抗体降解偶联药物)等药物共同构成了XDC这个大家族。
公司现有的三款进入临床试验的产品CBP-1008、CBP-1018、CBP-1019均属于PDC药物。
其中,CBP-1008是一款特异性靶向FRα/TRPV6的双配体偶联药物,用于治疗铂耐药复发性卵巢癌等多种肿瘤适应症。
资料显示,以铂为基础的化疗是卵巢癌治疗的主流手段,但在经历多次复发,会逐渐演变为铂耐药复发性卵巢癌(PROC)。包括紫杉醇、吉西他滨等非铂药物治疗方案治疗响应率低,客观缓解率仅有10%~20%,中位无进展生存期不足4个月,中位总生存约12个月。
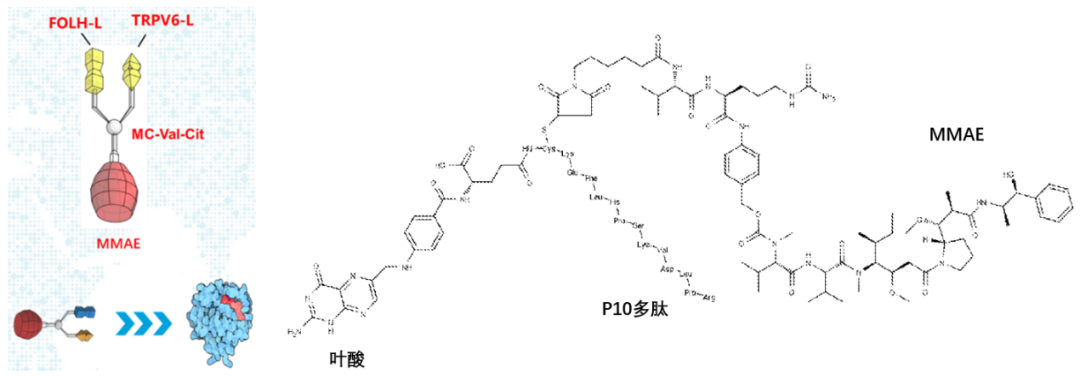
图:CBP-1008结构
从结构来看,CBP-1008的payload(细胞毒素)和linker(连接子)采用了Seagen开发的mc-Val-Cit-PAB+MMAE (即Vedotin 结构),该结构已经应用于Adcetris、Polivy、Padcev、爱地希等多款 ADC 药物上,DAR普遍在4左右,安全性较为可靠。
而在两个配体的选择上,同宜医药使用叶酸和一段P10多肽,分别靶向FRα和TRPV6。
资料显示,FRα在正常细胞中几乎不表达,而在实体瘤中有广泛高表达,比如间皮瘤(72-100%),三阴性乳腺癌(35-68%),卵巢癌(76-89%),非小细胞肺癌(14-74%)。
科学研究发现,FRα参与肿瘤调控,理论上通过抑制FRα可以达到控制肿瘤的效果。
然而自FRα于90年代被发现至今,目前仅ImmunoGen研发的Elahere这一款靶向FRα的药物获批上市,包括默沙东、卫材等多家巨头的偶联药物、单抗均以失败告终。
而Elahere这款ADC的开发历程,也并非一帆风顺。
其于2019年3月的第一个III期临床FORWARD I研究未达到主要终点,铂耐药/复发性卵巢癌患者未能获得无进展生存期统计学的显著改善。
痛定思痛的ImmunoGen选择将试验人群局限于FRa高表达的患者,在随后的SORAYA和MIRASOL研究中,针对FRa高表达的PROC患者,ORR分别达到31.7%和42.3%,疗效提升明显。
同宜医药也遇到了相似的情况,在CBP-1008的Ⅰ期试验中,49例PROC患者的ORR为18.4%,而若筛选FRα表达≥ 25%且前线治疗在三线以内的患者,ORR高达40%。
而与Elahere相比,CBP-1008最大的差异除了其使用多肽而非抗体作为靶向单元外,还在于其采取双靶点机制,其中一个可以为肿瘤特异性靶点,保证药物分子特异性的集中到肿瘤组织,另一个靶点可以为内吞靶点,介导分子内吞并释放毒素。
换句话说,CBP-1008将肿瘤特异性和/或内吞通过两个靶点组合来实现,并各自承担肿瘤靶向和内吞功能,因此巧妙的解除了传统XDC靶点限制的问题,把不易成药的两个单靶点,变成一对可成药的双靶点,实现“1+1>2”的效果。
而要做到这一点,则要归功于公司BEST™技术平台,核心是一个Bi-ligand(双配体)靶向结构和Tri-functional(三功能)连接子组成的系统,其模块化的设计嫩能够针对不同肿瘤提供多样治疗方案,赋予开发难度高的、不具成药性的分子新的活力。
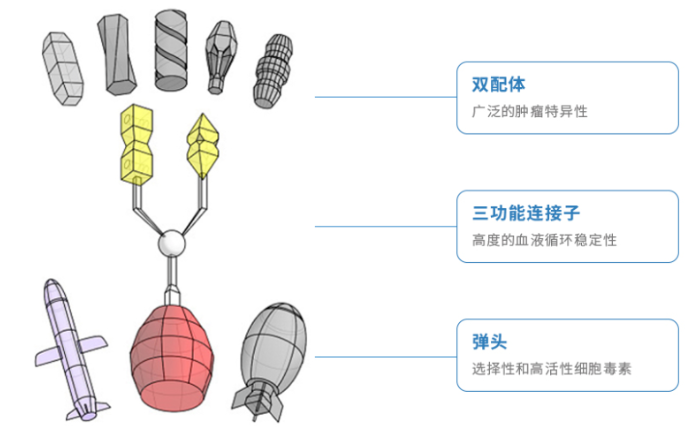
图:BEST™技术平台要素
在该技术平台的加持下,CBP-1008、CBP-1018、CBP-1019均进展顺利。
目前靶向FRα和PSMA的CBP-1018正在作为单药治疗进行临床I期试验, Ia临床试验显示良好安全性与明确临床效果,已进入Ib期拓展阶段,数据将于2023年10月在2023年欧洲肿瘤内科学会(ESMO)年会上公布。
而作为第二代技术平台产品,对受体的要求更低,临床上适应症的范围更广的CBP-1019的未来尤为令人期待,目前其Ⅰ/Ⅱ期临床试验已在中美两地启动。

除此之外,在同宜医药的新一代管线中,PROTAC与核素等新项目也十分亮眼。
据了解,公司C-PROTAC技术平台是一种全新的PROTAC药物递送技术,基于同宜的双配体偶联药物Bi-XDC技术,专门针对PROTAC的靶向递送进行设计和优化,使PROTAC具有肿瘤选择性和细胞渗透性。
核素项目中,同宜目前在研的Bi-RDC产品能够通过一或两个靶点精准靶向肿瘤,且双靶点具有协同效应,相比普通RDC产品更具优势。
展望未来,黄保华表示同宜将逐步拓展国际市场,和跨国药企合作开发,强强联合。
而随着临床试验不断取得进展,公司也正在加快推进IPO上市节奏,也许我们会在不久之后看到同宜医药登陆二级市场。
 XDC的时代机遇
XDC的时代机遇
自2019年底阿斯利康/第一三共的神药Enhertu(DS-8201)的上市,带动全球范围内ADC药物研发的火热,其背后的XDC家族备受关注。
与常规的药物不同,XDC药物以其鲜明的结构性令人印象深刻:靶向载体(Carrier)+载荷(Payload)+连接子(Linker),三者间既相互区分又相互影响。
这样特殊的构造意味这局部的创新将会带来整体效果的巨大改变,优化方式上更加多样,可拓展的能力更强,创新的潜力自然也就更大。
业界遂有”万物皆可偶联“的说法,这给Biotech带来了无穷的可能性。
而对于中国的初创公司而言,XDC带来的机会更是千载难逢。
一方面,自2014年到现在这一轮XDC从波谷到波峰的周期演进,正为中国的Biotech带来完美的时间差,以科伦、荣昌、百奥泰、同宜为代表的一些默默坚持的药企,怀揣沉淀多年的技术积累,迎来了登场时刻。
另一方面,XDC药物多模块的特质,使得其开发需要以一个系统工程开展,这正契合了中国医药在过去数十年来积累的全产业布局,国内长三角地区的CRO/CDMO企业就能满足各种工艺开发及生产要求。
而在XDC的内部,也有ADC、PDC、RDC等等区分,这意味着,入局者面对的是一个空间更大、时间维度更长的赛道。
在这样的赛道中赛跑,更加考验Biotech平衡短期与长期、创新与跟随、激进和保守的能力,在一场无限游戏中,相较于边界内的暂时领先,不断探索边界可能更为重要。
而同宜医药正是如此,公司正在不断拓展着技术的可能性,跳出传统规则的局限,打破药物界限,向难成药靶点发起挑战,为疑难杂症的治疗带来更多希望。
期待有更多像同宜医药这样的中国Biotech出现,为世界范围内的新药研发带来下一个突破。
—The End—
推荐阅读
内容中包含的图片若涉及版权问题,请及时与我们联系删除






评论
沙发等你来抢