
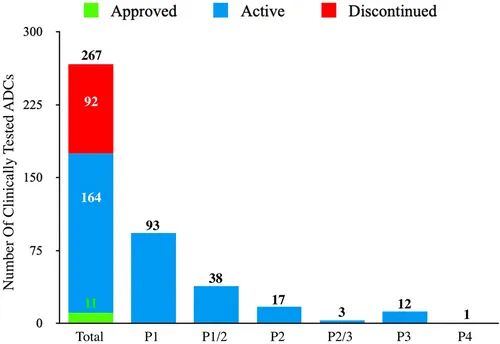
迄今为止,全球有 267 种ADC已在临床中针对各种肿瘤适应症进行测试,涉及超 1200 项临床试验。
近日,《mAbs》期刊上一热门文章,就ADC药物临床前景进行了深度分析,作者均为生物制药初创公司 Aarvik Therapeutics 的员工。
文章回顾了FDA批准的 11 种ADC药物、164 种目前正在进行临床试验但尚未批准的药物以及 92 种临床测试后终止的候选药物的临床情况。
这些经过临床测试的 ADC 通过其靶向肿瘤抗原、连接子、有效载荷选择和达到的最高临床阶段进行了进一步分析,突出了与已终止候选药物相关的局限性。

已进入临床试验的肿瘤ADC分析

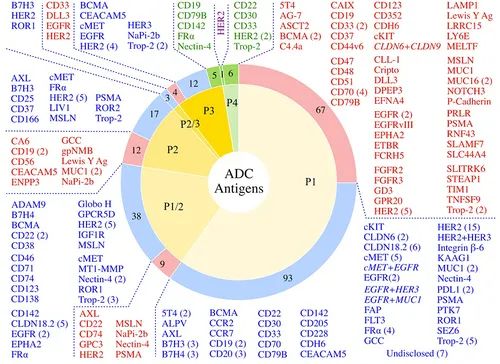
靶点总结
FDA 批准的 ADC(绿色部分,绿色文本) 164 种正在进行临床测试的ADC(蓝色部分,蓝色文本) 已终止的 ADC(红色部分,红色文本) 双抗原靶向 ADC 以斜体显示 紫色文本所示的 4 期 HER2 候选药物是维迪西妥单抗,已在中国获得批准,尚未获得 FDA 批准

Linker总结
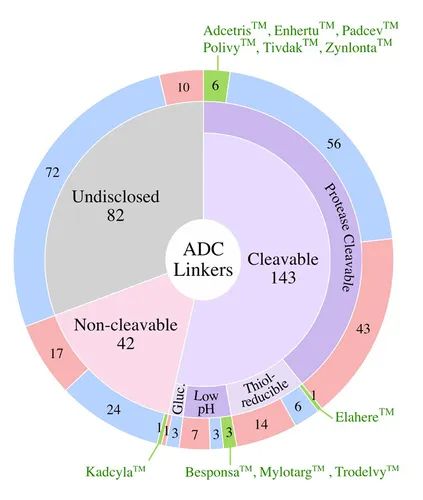
连接子分为两大类:可切割的和不可切割的。在临床 ADC 中,54% 使用可切割接头,这代表了最常用的接头类型。11 个FDA临床批准的 ADC 中有 10 个使用蛋白酶可切割的接头。
在临床测试的 ADC 中,16% 使用不可切割的接头,包括临床活性 ADC Blenrep TM。只有一种获得批准的 ADC Kadcyla TM使用不可切割的接头。31% 的临床测试 ADC 的连接子类别未公开。
下方是临床测试 ADC 中使用的连接子:
(1)FDA 批准的ADC(绿色)
(2)正在进行临床测试的ADC(蓝色)
(3)已终止ADC(红色)

Payload总结
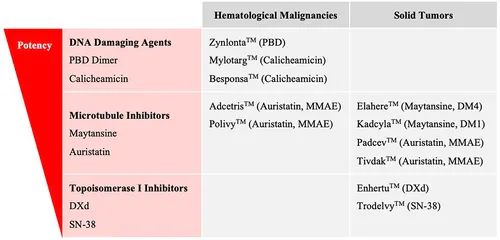
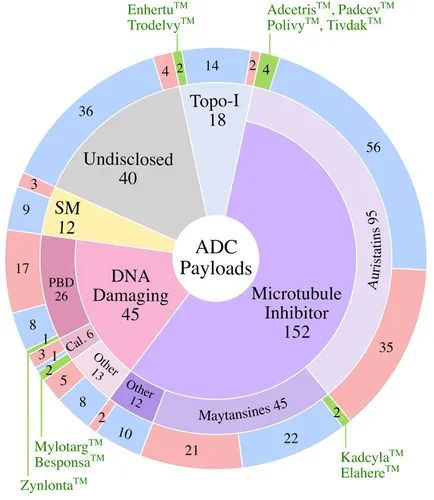
有效载荷分为四大类:微管抑制剂、DNA 损伤剂、拓扑异构酶 I 抑制剂、靶向小分子。
微管抑制剂是经过临床测试的最大有效载荷类别(57%)。11 种获批的 ADC 中有 7 种使用微管抑制剂有效载荷。
DNA 损伤剂构成了第二大有效载荷类别 (17%) 的 ADC。其中,45 个分子中有 26 个使用高效 PBD 有效载荷,其中只有一种获得 FDA 批准。另外两个已批准的 ADC 通过利用加利车霉素有效载荷来采用 DNA 损伤类。
拓扑异构酶 I 抑制剂含有 7% 。在 11 种获批的 ADC 中,有两种使用拓扑异构酶 I 抑制剂有效载荷。
除了这些传统的化疗有效载荷类别之外,大约 5% 的 ADC 还包含 Bcl-xL 抑制剂等靶向小分子,以及 TLR 和 STING 激动剂等免疫调节剂。这种非化疗有效载荷类别中的候选药物尚未获得 FDA 批准。15% 的临床测试 ADC 的有效载荷并未公开。
下方是临床测试 ADC 中使用的有效载荷具体信息:

缀合方法总结
在 267 个临床 ADC 中,111 个候选药物使用非特异性氨基酸缀合,72 个候选药物使用位点特异性缀合,84 个候选药物未公开 ADC 创建的缀合方法。
在利用位点特异性缀合的 ADC 候选药物中,2 种已批准(Enhertu TM和 Trodelvy TM)、50 种活跃药物和 26 种已终止 ADC 接受了临床测试。
除了 DAR = 8 ADC(例如 Enhertu TM和 Trodelvy TM)利用所有天然二硫键进行缀合外,其余 ADC 均采用位点特异性缀合方法,保留四个链间二硫键或将其替换为化学共价键(例如二硫键重桥)。

267种临床ADC药物
已批准的 ADC
在 FDA 迄今已批准 12 种 ADC 中,针对血液系统恶性肿瘤和实体瘤恶性肿瘤各 6 个。其中,9 种获得了加速有条件批准,2 种被撤回批准(Mylotarg TM和 Blenrep TM )。
由于安全性与临床效益问题,Mylotarg TM于 2010 年被撤回,于 2017 年以较低剂量与化疗联合重新获得批准。BlenrepTM于 2022 年被撤回,因为验证性试验未达到必要的批准后疗效终点。
作者对FDA批准的 ADC 按有效载荷类别分类。显示了 ADC 药物名称、目标抗原以及有效载荷的名称和化学结构。
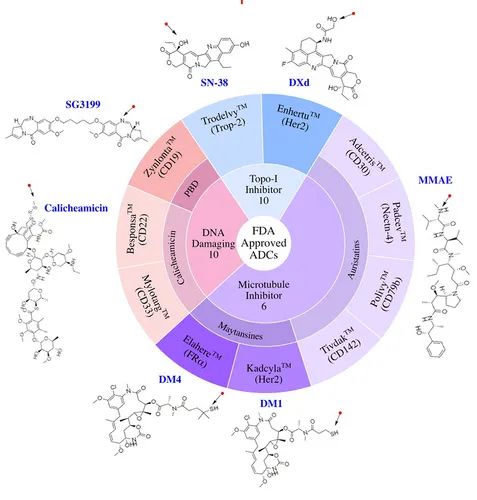
目前 FDA 批准的 11 种 ADC 中,有 6 种利用微管抑制剂有效载荷,3种使用 DNA 损伤性有效载荷,而 2 种则携带抑制拓扑异构酶 I 的有效载荷 。
这些有效载荷涵盖从高效 DNA 损伤剂 PBD (IC 50 ~ pM) 到低效拓扑异构酶 I 抑制剂 SN-38 (IC 50 ~ nM) 的一系列效力。
已批准的 ADC 在针对血液恶性肿瘤时使用了较高效力的有效载荷,而在针对实体瘤则使用了较低效力的有效载荷。
在实体瘤环境中发挥功效所需的更高的药物暴露可能会限制更高效力有效载荷的利用,据报道在优选的生物剂量下全身毒性增加。
正在进行临床测试的ADC
在 164 种活跃 ADC 中,约 7% 处于 3 期临床测试。这些活性后期 ADC 靶向以下肿瘤抗原:BCMA(belantamab mafodotin)、CEACAM5(tusamitamab ravtansine)、c-Met(telisotuzumab vedotin)、HER2(曲妥珠单抗 duocarmazine 和曲妥珠单抗 rezetecan)、HER3(patritumab deruxtecan)、NaPi-2b (upifitamab rilsodotin)和 Trop-2(datopotamab deruxtecan 和 SKB264)。
在这些 ADC 中,约54%使用微管抑制剂有效载荷,10%是 DNA 损伤,约9%是拓扑异构酶 I 抑制剂有效载荷,还有约 22% 有效载荷未公开。
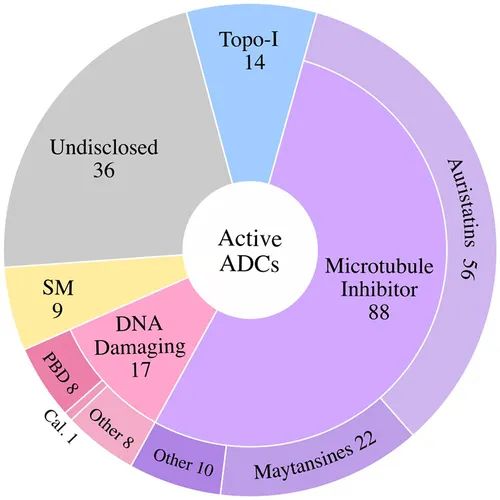
在微管抑制剂 ADC 中,阿里他汀含量最丰富,其次是美登素。在 DNA 损伤有效载荷类别中,PBD 占临床活性 ADC 的约 50%。
从靶向的癌症抗原来看,约 16% 靶向血液肿瘤抗原,约 80% 靶向实体瘤抗原,约 4% 针对在血液和实体瘤恶性肿瘤中表达的癌症抗原。
最常见的靶向肿瘤抗原包括:HER2(32 种候选抗原)、Trop-2(11 种候选抗原)、CLDN18.2(11 种候选抗原)和 EGFR(8 种候选抗原)。
已终止
ADC的终止可归因于以下三个原因中的一个或多个:
(1)由于不可耐受的毒性而导致的治疗效果不足
(2)由于功效不足而导致的治疗效果不优于当前的治疗标准
(3)商务/商业考虑
大约 29% 的经临床测试ADC将无法耐受的毒性作为项目终止的原因,其潜在因素包括:
靶向/脱肿瘤毒性
对需要更高生物暴露的抗原使用非常高效的有效载荷
不稳定的接头导致有效载荷在肿瘤外释放
脱靶毒性,可能是由于 ADC 的胞饮作用
有效载荷代谢转化为毒性更强的代谢物
从有效载荷来看,微管抑制剂占已停产候选药物的 63%,其次是 DNA 损伤有效载荷 (约 27%),拓扑异构酶 I 抑制剂、靶向小分子和未公开的有效载荷合计占已终止 ADC 的 10%。
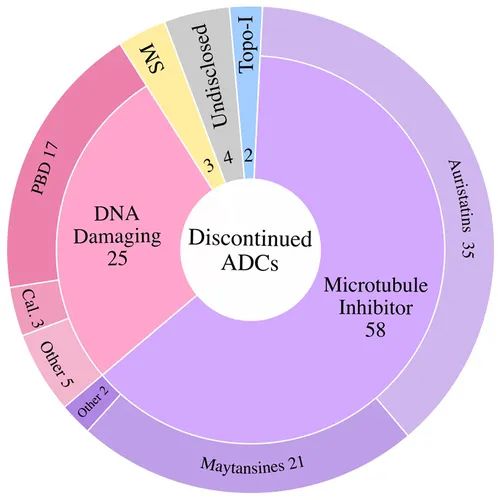
导致功效不足的因素包括:
肿瘤靶抗原密度低和/或已停产 ADC 的内化特性差
有效载荷效力不足
异质 DAR ADC 产品导致有效载荷剂量不理想
肿瘤外有效载荷肿瘤中药物释放和/或不完全释放
由于 PK 特性较差而导致 ADC 快速清除
未能证明疗效优于标准治疗
通过肿瘤中药物外流转运蛋白升高介导的多药耐药性
说在最后
在针对肿瘤适应症进行测试的 267 种 ADC 中,有 11 种已获得 FDA 批准,92种已终止。
对已终止候选药物相关局限性的分析有助于为下一系列分子的设计和选择提供信息。采用综合、多因素的方法,仔细选择目标,同时优化抗体、接头和有效载荷将有望迎来下一波新的 ADC 批准。
参考链接:
https://www.tandfonline.com/doi/full/10.1080/19420862.2023.2229101



内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢