


英伟达投资的第8家


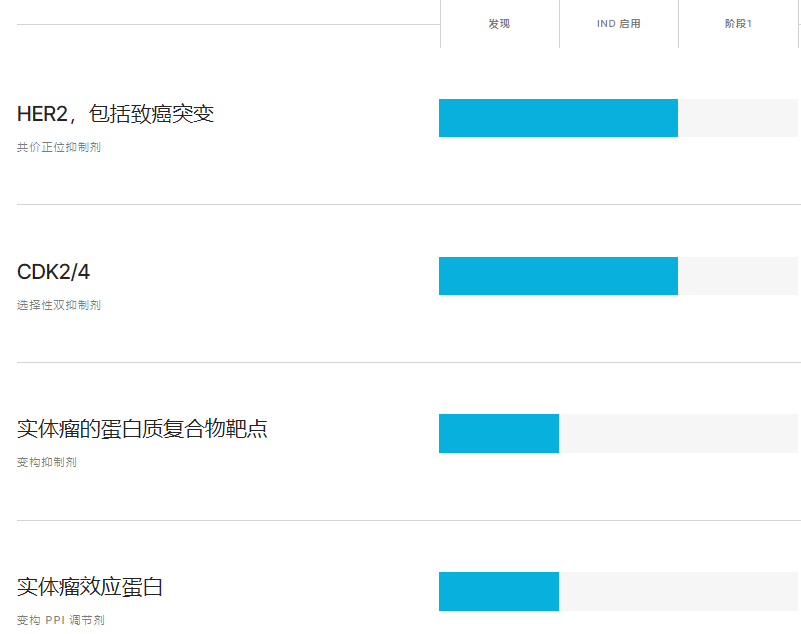
IAM-H1 是一种高效且不可逆的酪氨酸激酶抑制剂 (TKI),选择性靶向 HER2 和 HER2 突变体,同时不影响 EGFR。HER2 的扩增和突变导致多种人类癌症。HER2 TKI 的成功有限,因为其补偿机制使所需的治疗指数超出了现有的泛 ERBB 和 HER2 抑制剂。
IAM-H1 对 EGFR 表现出超过 1000 倍的选择性、良好的 PK 和安全性、优先的肿瘤富集和有效的 CNS 外显率。这些共同使 IAM-H1 成为突破性分子,可实现抑制 HER2 信号传导的全部治疗潜力,同时避免 EGFR 驱动的毒性。
在体内,IAM-H1 在一系列 HER2 肿瘤模型(包括颅内模型)中表现出良好的疗效和耐受性,优于基准 TKI 和抗体药物偶联物 (ADC)。
一项多中心 I 期试验计划于 2024 年初开始对患者进行给药。
IAM-C1 是一种潜在的一流选择性双 CDK2/4 抑制剂,可解决细胞周期驱动的癌症在治疗窗和治疗耐药性方面未满足的需求。
IAM-C1 是一种一流的小分子抑制剂,专门针对 CDK2 和 CDK4,这两种细胞周期激酶在各种癌症中经常失调。通过选择性抑制 CDK2/4,同时保留其他密切相关的 CDK(包括 CDK1、CDK6 和 CDK9),与临床批准的 CDK4/6 抑制剂相比,IAM-C1 有可能提供更大的治疗益处。
IAM-C1 代表了一种有前途的解决癌症细胞周期失调的新方法,它建立在二十年研究和临床经验的基础上。CDK4/6 抑制剂是 HR+/HER2- 转移性乳腺癌 (mBC) 患者一线和后续治疗的标准治疗方法。
尽管这些药物取得了成功,但许多患者表现出对已批准的 CDK4/6 抑制剂的内在耐药性或获得性耐药性。HR+/HER2- mBC 仍然是发病率和死亡率的一个重要原因,导致患者需求未得到满足。
IAM-C1 更具针对性的方法通过减少与非 CDK2/4 激酶(包括 CDK6)相关的剂量限制毒性,提供了更有利的安全性。
参考链接:
https://www.fiercebiotech.com/biotech/iambic-ups-rhythm-ai-enabled-race-clinic-revealing-100m-round-and-nvidia-pact
https://www.iambic.ai/pipeline
内容中包含的图片若涉及版权问题,请及时与我们联系删除






评论
沙发等你来抢