
点击蓝字 关注我们

微末生物
Nanomega BioAI
真核细胞内部有着非常复杂的膜系统。在一个真核生物细胞中,各种细胞器由膜脂包围形成,而不同细胞器膜之间又存在着密切而必要的分子交换和生物学相互作用。
在这些生物膜系统中,膜接触位点(Membrane contact sites,MCS),也就是细胞器的膜与膜互相接触的部分,对膜与膜之间脂质及其他小分子的物质交换起着重要作用。然而,在膜与膜之间这么小的地方,究竟是什么样的分子介导着物质交换呢?这是一个长期令细胞和分子生物学家感到疑惑的重要问题。
在本文中,周正洪教授团队及其合作者对内质网-线粒体接触结构“线粒体相关膜”(mitochondria-associated membranes,MAMs)中一种重要的蛋白质结构域【SMP】(synaptotagmin-like mitochondrial lipid-binding protein)形成复合物以及结合磷脂分子的特点进行了研究,并使用负染色电子显微(negative-stain EM)和三维重构(单颗粒分析)的方法,确定了构成这一结构域中的三个蛋白亚基的复合结构,最终阐明了这一重要生物学过程的分子运作机制。文章发表在美国国家科学院院刊(PNAS)上。
细胞器间的“桥”与“渡”——ERMES
一系列复杂而相互联系的有膜细胞器共同组成真核细胞的生物膜系统。这些膜隔开了一个个相对独立的空间,确保了不同的生化反应的有效分离,但也阻碍了分子的交换。
在所有细胞器中,内质网(ER)是唯一可以合成其自身所需的全部磷脂分子的细胞器。这就要求在不同细胞器间能够进行快速的磷脂交换,尤其是其他细胞器来与内质网进行磷脂交换,这样才能获取足够的磷脂分子构成不断流动和代谢中的细胞器膜。虽然大多数细胞器是通过“囊泡运输”的方式来获得脂质,但其他很多重要的细胞器,如承担了细胞能量供给任务的线粒体,并没有与这些途径相连。
既然脱离了囊泡流动的方式,真核细胞的线粒体就必须通过非囊泡机制,也就是利用膜接触位点(membrane contact sites,MCS),或两个细胞器之间的接近区域来进行细胞内重要小分子的转移和交换。人们已经知道,内质网和线粒体之间的被称为“线粒体相关膜”(MAMs)的物理连接与脂质的非囊泡运输有关。
然而,在MAMs处发生分子运输的具体机制尚不清晰。越来越多的证据表明,连接细胞器与细胞器之间的蛋白复合物在接触点的磷脂交换中起潜在作用。这些复合物通常由位于内质网和相关细胞器表面的可溶性蛋白和膜蛋白组成。
对于内质网与线粒体的接触位点而言,一种被称为“内质网-线粒体接触结构”(ERMES)的多亚基复合体已被证明在酵母中提供了一个连接内质网与线粒体外膜的桥梁。【ERMES】复合体包括各种令人眼花缭乱的蛋白分子:可溶性蛋白Mdm12、ER驻留膜蛋白Mmm1、两个线粒体外膜蛋白Mdm10和Mdm34以及线粒体调节蛋白Miro GTPase Gem1。
氨基甘油磷脂(一类脂质,对膜来说是必要的)的生物合成需要内质网和线粒体之间广泛的磷脂化学前体的交换,而在没有ERMES的情况下,一些关键的合成过程将会受到损害。
ERMES还有一位“同事”,这就是被称为“液泡和线粒体补丁”(vCLAMP)的第二种复合物。它连接液泡和线粒体,通过将内质网衍生的脂质从液泡输入到线粒体,减轻了作用于ERMES的细胞损伤为磷脂合成带来的损失。
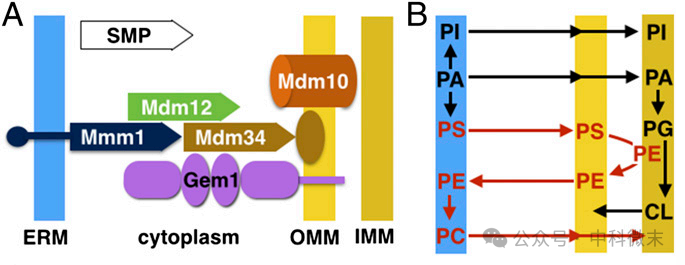
图1: ERMES与磷脂代谢,左图表现了内质网膜(蓝色)和线粒体外膜(浅黄色)之间的蛋白质接触情况,右图表现了两个细胞器之间多种磷脂的交换与合成关系
在ERMES的3位成员:Mdm12、Mmm1和Mdm34中,都存在一个“突触聚集蛋白样线粒体脂质结合蛋白”(SMP)结构域(图1A)。虽然SMP结构域的功能尚未完全了解,但许多侧面证据都表明其可能在脂质转运中发挥作用。
问题在于,到目前为止,ERMES是否直接参与磷脂交换仍缺乏绝对明确的证据。我们仍然缺乏关于ERMES成分的结构性质(即亚基结构和化学计量学)如何与配合物的功能相关的基本知识。为了帮助弥补这些差距,周正洪教授的研究团队及其合作者结合了计算建模、分析生物化学和冷冻电镜等多种综合性的生物学方法来阐明保守的SMP结构域作为ERMES的关键组成部分的作用。
在文章中,他们首次报道了ERMES亚复合物的结构,揭示了Mdm12和Mmm1的SMP域之间独特的组装模式,还证明了Mdm12桥接了Mmm1和Mdm34的形式为膜系结提供了结构基础。最后,他们指出,SMP结构域能够结合磷脂,并支持ERMES直接参与磷脂交换,为这一重要分子生物学问题提供了重要思路。
化整为零,解开SMP结构域之谜
1. 同源分析,确定SMP结构域保守性
在酵母中,Mdm12是一种可溶性蛋白,Mmm1是一种内质网膜蛋白。研究团队使用生物信息学方法进行了预测,并对这两种蛋白SMP结构域的片段进行了计算机的比较建模。通过利用蛋白质结构数据库(PDB)中的信息对两个SMP结构域进行比较同源建模,研究人员确定人类E-SYT2蛋白的SMP结构域为最佳模板。
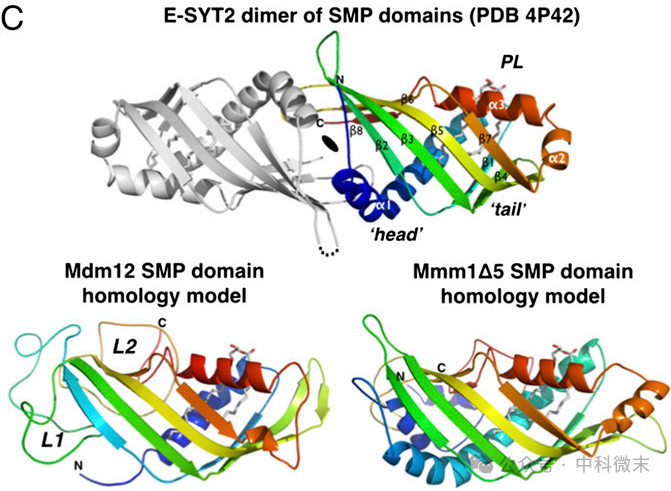
图2:上为人E-SYT2的SMP结构域,下为酵母Mdm12和Mmm1的SMP结构域,可以看出E-SYT2有着很好的结构代表性
E-SYT2的SMP结构域形成一个二聚体,其中每个单体单元包括一个不完整但高度扭曲的七链β-桶和三个α螺旋(α1、α2和α3),α2部分覆盖了桶的一端,内部脂质结合腔内排列有疏水残基。
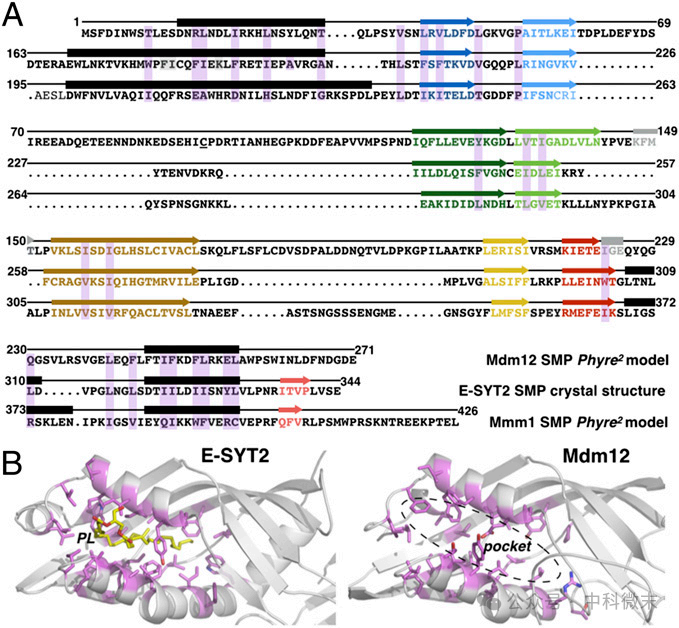
图3:Mdm12&Mmm1氨基酸序列与E-SYT2比对/E-SYT2和Mdm12的SMP结构域的结合
经比对,研究人员发现Mdm12和Mmm1与E-SYT2结构非常相似:Mdm12或Mmm1的SMP模型与模板E-SYT2晶体结构之间的误差非常小,仅为~1A。在Mdm12和Mmm1中,内部腔内排列着疏水残基,其尺寸、几何形状和化学性质与磷脂等疏水配体的结合相一致,猜测有结合脂质的功能,且与E-SYT2相似。
2. 蛋白关系阐明:紧密的异质四聚体,和连接不同蛋白的桥梁
研究团队提出假说:正式SMP结构域,介导了ERMES的亚基们组装成一个链状的分子系统。因此,他们设计实验探索了Mdm12和Mmm1的SMP结构域形成复合物的倾向。
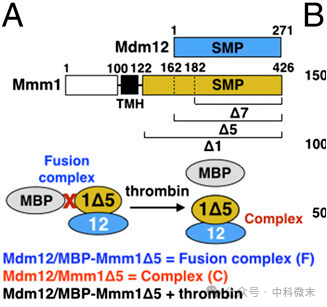
图4:确定组成复合物的蛋白分子关系的生化实验
利用分子克隆和亲和层析等生物化学方法,研究人员找出了Mmm1与Mdm12相互作用所需的最小结构部分;他们还继续使用SEC耦合多角度静态光散射(SEC-MALS)方法来确定Mdm12/ Mmm1Δ5配合物的化学计量,并最终确定Mdm12和Mmm1两种蛋白形成了一个化学计量比为2:2的四聚体。
人们最终发现,Mdm12/Mmm1的最小复合物是由其SMP结构域介导的。最重要的是,因为Mdm12/Mmm1的完整细胞质部分Δ1,与Δ5或Δ7(图4)这两种蛋白的“部分片段”在组成复合物方面行为相同,所以122—181位氨基酸组成的蛋白质片段对复合物的形成不是必需的。为了组装这个复合物,一个Mmm1的二聚体招募了一个Mdm12的两个单体。
研究人员还探究了另一种复合物中的成员,Mdm34的SMP结构域(以下称为“Mdm34-SMP”)在复合体组装中的作用。融合蛋白等生化实验结果表明Mdm12“桥接”了Mmm1和Mdm34的SMP结构域。
我们知道,在ERMES中,Mdm34和Mmm1是唯一被膜锚定的含有SMP的亚基;而基于这些生化和细胞学数据,可以提出几种可能的SMP组装模型(图5)。
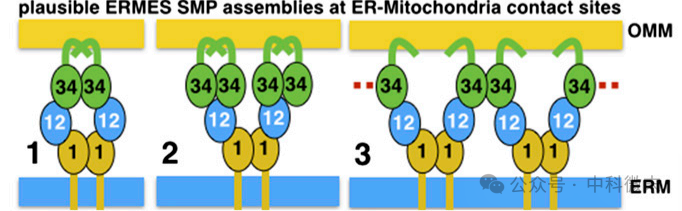
图5: ERMES SMP 组装模式图
3.质谱证明:Mdm12与Mmm1倾向结合卵磷脂
为了检测Mdm12的磷脂结合偏好,使用过量的包含一种给定磷脂的混合胶束和非竞争的去垢剂LDAO(最终浓度为0.2mM),观察Mdm12在其中与磷脂的结合。在去垢剂存在的情况下,磷脂分子团能够分裂成由以自由磷脂、胶束、聚集体物和混合胶束等方式存在的状态。尽管经过广泛的纯化(即4到5个色谱步骤),磷脂仍然与重组蛋白结合,这表明该蛋白其具有相对较高的结合亲和力。
根据E-SYT2的蛋白质三维结构信息,Mdm12的SMP结构域可能主要与磷脂的酰基链相互作用。而该研究得到的数据确实证明了Mdm12混杂地结合了PS、PC等各种各样的甘油磷脂,但也对于不同磷脂表现出了或大或小的结合能力,因此生化实验也表明这一蛋白在结合磷脂方面存在着“隐性”的选择能力。
这些结果表明,Mdm12和Mmm1的SMP结构域是真正的脂质结合蛋白,而且更倾向于结合一种特定的磷脂类型——磷脂酰胆碱。
4.负染电镜结合三维重构算法揭示分子体系结构
重组的Mdm12/Mmm1Δ5和Mdm12/Mmm1Δ1复合物用负染电镜检测。在负染色处理和透射电子显微镜下,两种复合物负染色颗粒的2D类平均结果(图6,A-C)都显示出相似的细长、新月形颗粒,粒子之间具有高度的均匀性。
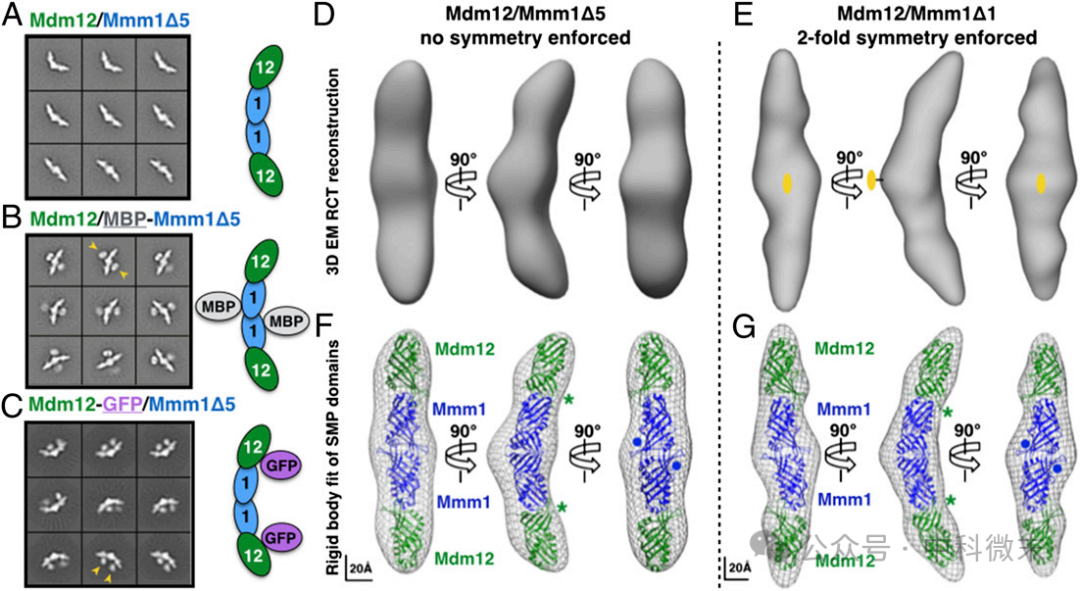
图6: Mdm12-Mmm1复合体在负染色电子显微下计算出的三维结构
为了获得这些分子的三维结构,研究团队首先使用随机锥形倾斜(RCT)方法对Mdm12/Mmm1Δ5配合物进行了三维重建,它可以根据所提供的图像生成3D图纸。这一重建过程得到了一幅35-Å分辨率的电子显微图(图6,D,F),显示了与2D类平均图像一致的结构特征。有趣的是,尽管在三维重建过程中没有应用对称,重建结果却显示了强烈的双重旋转对称性。
接下来,利用上述Mdm12/ Mmm1Δ5复合物的RCT 3D图作为初始模型,并应用双重对称性,从负染色粒子图像中将Mdm12/Mmm1Δ1复合物的3D EM图重建达到17Å的分辨率(图6,E,G)。除了分辨率的差异外,两种配合物的重建结果高度相似。
总的来说,电子显微镜用“眼见为实”的证据告诉我们,Mdm12/Mmm1复合体总体是呈新月形的,呈双重对称,沿三个主轴的尺寸为∼210×45×35Å。
所得到的图纸也可以用于拟合E-SYT2 SMP域的晶体结构。在最终得到的蛋白质结构模型中,四个管状SMP结构域几乎对齐;磷脂结合腔每个SMP结构域都可以重新排列,形成一个大的、准连续的疏水通道,用于在内质网和线粒体之间运输脂质。
总结:ERMES的SMP结构域与可能的磷脂运输机制
研究人员通过生化实验和电镜方法相结合的实验设计,揭示了ERMES复合物中【SMP结构域】的两个重要特性:
首先,它们能够与磷脂结合;
其次,它们还能够介导Mmm1、Mdm12和Mdm34之间的物理相互作用。
目前在细胞生物学界,有一个吸引人的假说——这些含有SMP结构域,有磷脂结合能力的蛋白起到了典型的脂质转运蛋白(lipid transfer proteins,LTP)的作用。而在内质网-线粒体接触微点中含有SMP的蛋白,在脂类合成酶中高度富集,也支持了ERMES起到转运脂类作用的假说。
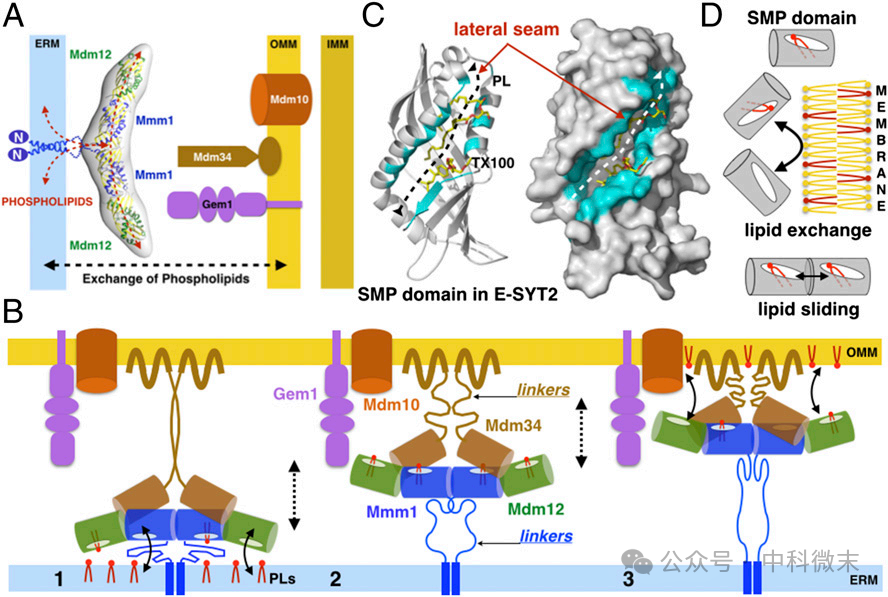
图7:SMP结构域在细胞膜连接复合物与磷脂转移过程中起重要作用
周正洪教授团队及其合作者完成的这项工作,在领域内提供了第一个详细的ERMES的生化和结构分析结果,揭示了其在内质网-线粒体接触位点的膜系结和磷脂交换中具有双重作用,并为理解其他膜接触部位含SMP的系结复合物的结构和功能提供了基础。
在研究过程中,负染色电镜和三维重构的实验部分对复合物状态的最终阐明起到了重要作用。在分子生物学等方面的科研工作中,诸如此类使用冷冻电镜、负染色电镜并结合三维重构来获取“眼见为实”结构的方法,往往能够为分子事实的阐明和印证提供重要帮助。
中科微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够使用负染色电子显微镜、冷冻电子显微镜等多种电子显微学方法,在亚原子级和原子级分辨率上解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
《美国国家科学院院刊》(PNAS)是美国国家科学学院(NAS)下属的一份同行评审期刊,是广泛涵盖生物、物理和社会科学的高影响力原创研究的权威来源。该期刊的范围是全球性的,向全世界的所有研究人员开放投稿。它成立于1914年,是世界上被引用最多、综合性最强的多学科科学期刊之一,每年发表3500多篇研究论文。
PNAS一直致力于只发表最高质量的科学研究,并使这项研究能够为广大读者所接受。此外,PNAS还发布科学新闻、评论、观点、特辑、播客和NAS成员简介。其在2022年的影响因子为11.1。
内容中包含的图片若涉及版权问题,请及时与我们联系删除





评论
沙发等你来抢