

近日,来自蛋白质设计先驱 David Baker团队又发布了一项新成果:首次使用生成人工智能(AI)来设计制造全新的抗体。
这一成果也被《自然》杂志评论为“具有里程碑意义的时刻”,生成式AI进入一个高达数千亿规模的市场。

2023年,全球抗体药物市场规模达到2328亿美元,其中Keytruda销售额250亿美元登顶药王,抗体药物成为医药市场重要的一类药物。
但治疗性抗体的开发仍然依赖于动物免疫或抗体库的筛选来识别与所需靶标结合的候选分子,这些方法费力、耗时,并且可能无法产生与治疗相关相互作用的抗体。
Baker团队通过从头计算设计抗体的方法,能够针对结合靶标的特定表位设计抗体,并且成功地得到试验验证。
英国牛津大学免疫信息学家Charlotte Deane)表示,“这是一项非常有前途的研究”,它代表了应用人工智能蛋白质设计工具制造新抗体的重要一步。
这项工作或将成为基于结构的抗体设计新时代的基础,未来十年,抗体药物的研发方式将由此改变。
 从蛋白质设计到抗体设计
从蛋白质设计到抗体设计
蛋白质从头设计发展迅速,越来越多的落地成果开始出现。
去年,David Baker实验室公布了RFdiffusion引发了行业震动,这是一种基于扩散模型的深度学习模型,能够一键生成原子精度的世界上不存在的蛋白质。
不过,尽管这些模型在蛋白质相关的设计已经逐渐成熟,但RFdiffusion主要集中在蛋白质界面设计,例如binder(结合剂),因此无法从头开始设计抗体。
于是,研发人员通过对RFdiffusion进行微调,用数千个经过实验确定的抗体结合到目标抗原蛋白的结构以及其他的抗体样分子的相互作用。
微调后的RFdiffusion能够从头设计结合指定表位的纳米抗体(也被称作单域抗体)。
利用这种方法,研究人员针对一系列与疾病相关的靶点设计了数千种纳米抗体,包括艰难梭菌毒素B(TcdB)、流感H1血凝素(HA)、呼吸道合胞病毒(RSV)位点I和III、SARS-CoV-2受体结合域(新冠肺炎RBD)和IL-7R。
然后,他们在实验室中制作了一部分设计,并测试了这些分子是否可以与正确的靶点结合,结果显示大约1%的从头设计的抗体可与目标蛋白成功结合并发挥作用,具有中等亲和力水平。
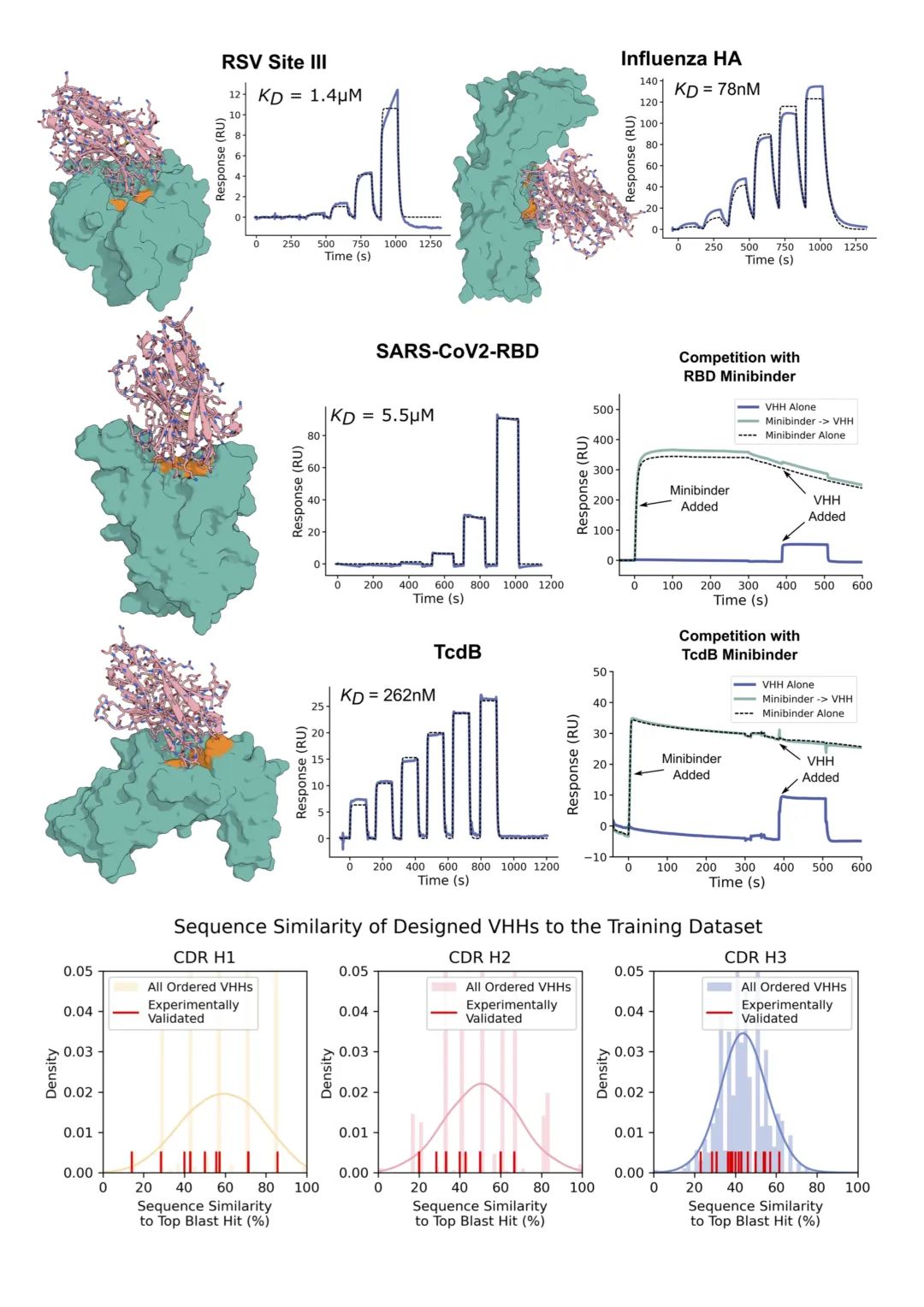
高分辨率冷冻电镜结构显示,所设计的与流感血凝素结合的抗体的在CDR环的配置和整体结合姿态方面与设计模型几乎相同!
这证明了从头设计抗体已经精确到原子水平,该生成模型能够设计多样化且真正从头开始的抗体,具有广阔的前景。
 还有很长的路要走
还有很长的路要走
已有少数几家公司开始使用生成式人工智能来帮助开发抗体药物,其他绝大多数公司仅仅针对天然抗体进行优化,具有较大局限性。
尽管该试验意义重大,我们也没必要高兴地太早,因为这项工作还不算解决抗体药物设计问题。
首先这只是一项概念验证研究,因为生成的纳米抗体仅有1%达到了预期效果,并且只有中等亲和力水平。(78nM-790nM)
这一成功率低于Baker团队目前使用其他类型的人工智能设计的蛋白质所取得的成功率。
而任何用于治疗的抗体也需要对其序列进行修饰,让其类似于天然的人类抗体,以免引发免疫反应。包括后续关键药物特性的优化,如聚集性、溶解性和表达水平,也有待解决。
此外,研究所设计的纳米抗体(单域抗体),类似于骆驼和鲨鱼中发现的抗体,当前FDA仅获批两种类似疗法,更多疗法还处于临床试验中。
也就是说,本次研究中设计的抗体不是能够更广泛成药的复杂蛋白质。
但是它首次表明准确的从头抗体设计是可能的。纳米抗体更容易设计,也更容易在实验室中研究,因此首先设计这些抗体具有重要意义,这项工作能为未来的发展奠定基础。
研究人员表示,紧密匹配的人类CDR序列,降低所设计的抗体的潜在免疫原性是一个大方向,而RoseTTAFold2抗体预测方法的改进应该会提高实验成功率,并允许更好地对上游设计方法进行计算机基准测试。
未来当成功率增加时,应该比免疫动物或筛选随机文库更快、更便宜,极大地减少开发成本和时间。
David Baker的团队希望 RFdiffusion 能够帮助解决已被证明具有挑战性的药物靶标,例如 G 蛋白偶联受体等。
距离一键生成人们想要的抗体药物,日子已经不远了?
参考链接:
https://www.nature.com/articles/d41586-024-00846-7
https://www.biorxiv.org/content/10.1101/2024.03.14.585103v1.full.pdf




内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢