
点击蓝字 关注我们

微末生物
Nanomega BioAI
病毒入侵细胞直至组装释放的过程受到各种生物分子的复杂调控。在病毒的整个生活史中,不同生物大分子间密切互作,蕴含着复杂的生物学机制。人们长期以来希望对这些过程的生物学原理进行解析,不仅仅是为了对病毒的生命现象进行科学认识,更是为了能够通过开发小分子药物、疫苗等方法来影响这一过程,从而对病毒进行抵抗。
在病毒整个生命周期的末尾,散布在细胞质内的病毒蛋白需要被“收集”起来,与其基因组核酸分子一起组装成复杂的病毒颗粒,并最终从细胞内释放。然而,不同种类的病毒释放在这一生命过程中所采取的策略截然不同。
与真核生物普遍以双链的DNA分子(dsDNA;单链single strand缩写为ss,ss有正负之分)作为基因组不同,病毒基因组的构成几乎囊括了核酸分子的所有存在形式。根据病毒学界巴尔的摩(Baltimore)分类法,基于基因组物质基础的不同,病毒一共可以分为七大类:第一类dsDNA病毒,如腺病毒和天花病毒;第二类+ssDNA病毒,如M13噬菌体;第三类dsRNA病毒,如呼肠孤病毒;第四类+ssRNA病毒,如冠状病毒;第五类-ssRNA病毒最为致命,如流感、狂犬病、埃博拉病毒;第六类和第七类分别为以+ssRNA和dsDNA作为衣壳内基因组的逆转录病毒。
将病毒根据基因组成分不同进行分类,有助于人们认识拥有不同基因组的病毒颗粒的不同组装方式。在最为经典的dsDNA病毒中,未成熟的基因组将会通过马达蛋白被输入到已经预先组装好的完整衣壳内部,这被称为“核填充模型”;而在ssRNA病毒中,基因组直接参与到衣壳蛋白的搭建中,起一定的骨架作用,这被称为“共搭建模型”。然而,对于巴尔的摩第三类dsRNA病毒来说,这一过程究竟是以何种机制完成,长期以来存在争议。一些模型显示,dsRNA可能通过核填充的方式进入衣壳;但也有相反的模型表明,dsRNA和衣壳蛋白的关系为同步共同组装。
两种模型孰对孰错?2024年4月12日,加州大学洛杉矶分校周正洪教授团队在Cell上发表题为RNA genome packaging and capsid assembly of bluetongue virus visualized in host cells的论文,利用冷冻电镜三维重构(cryo-EM)方法和结构生物学领域最为先进的cruo-FIB和cryo-ET等多种方法,阐明了dsRNA病毒在宿主细胞内组装的的机理(图1)。
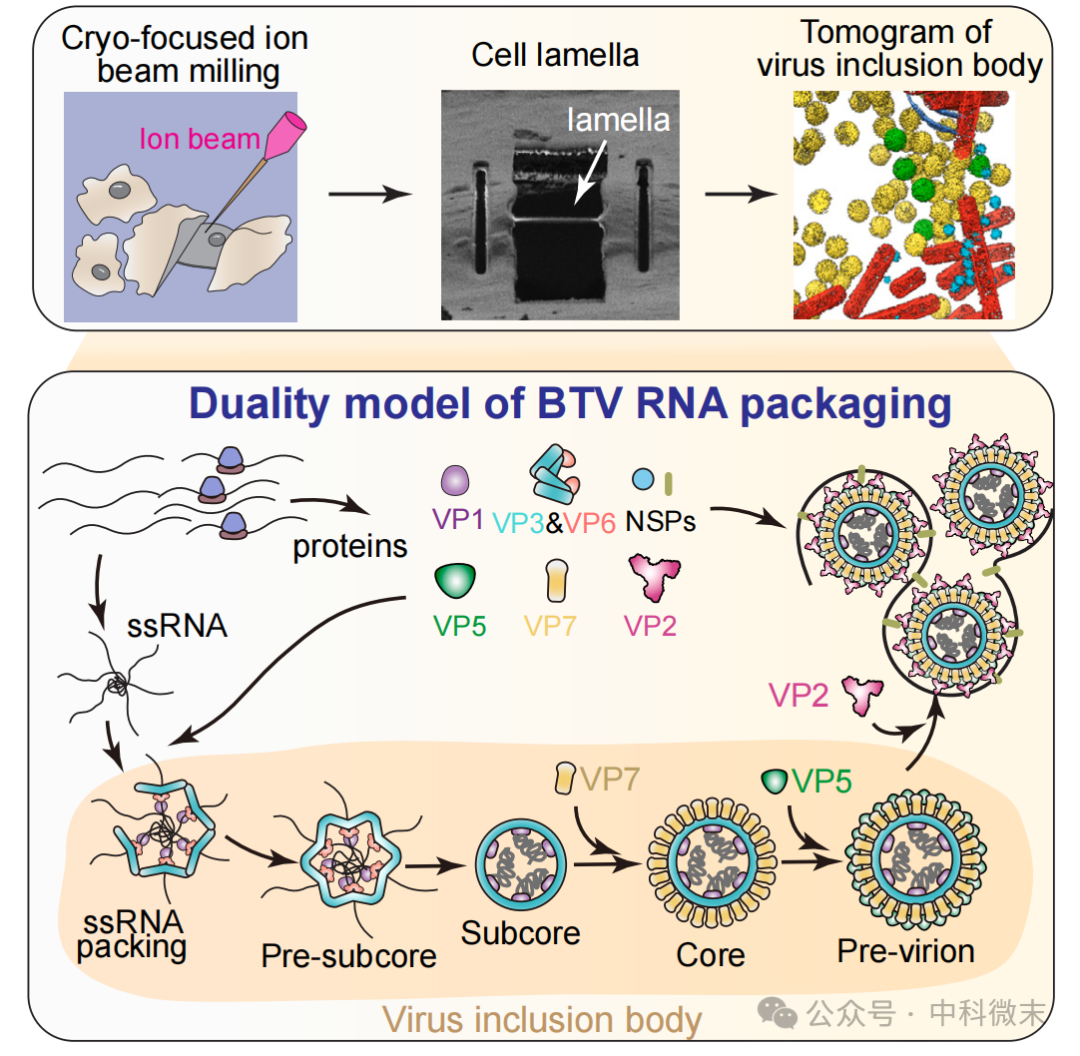
图1:周正洪教授团队利用冷冻电镜解决dsRNA病毒包装难题
周正洪教授团队多年来一直以蓝舌病毒(bluetongue virus,BTV)为对象,综合利用结构生物学和生物化学方法来研究dsRNA病毒的生命周期。团队曾在2021年于Nature Microbiology发文,首次阐明了BTV病毒在低pH条件下表面衣壳蛋白的动态结构及其入侵宿主细胞的生物学机理。BTV是无囊膜、双链RNA病毒的一个典型代表,能够感染牲畜而引起致死性的传染病,并能够感染人体引起腹泻。
BTV病毒和同样能导致人体腹泻的轮状病毒(rotavirus)属于呼肠孤病毒科下的无包膜亚科,和轮状病毒等典型的dsRNA病毒有着相似的外形结构。其颗粒主要由三层衣壳蛋白+10段双链RNA基因组构成。病毒的衣壳蛋白最内层为VP3(virus protein3,病毒蛋白3),它与基因组RNA直接接触,并在最初始的病毒结构组装中发挥作用;衣壳中间层为VP7;外层为功能性的膜穿孔蛋白VP5和受体结合蛋白VP2。在已经确定的病毒生活周期内,其10段基因组片段首先以ssRNA的形式包装进衣壳内,然后在衣壳内经历复制,成为dsRNA。
BTV病毒具有多层复杂结构,组装过程高度动态,其中间状态难以捕捉。这导致整个病毒的生活过程极为复杂,尤其是关于其在病毒颗粒组装方式上的争论,在领域内始终是悬而未解的“顶级难题”。
揭开病毒生物学奥秘的“科学利器”
——多种冷冻电镜成像方法
提到“结构生物学”,人们更多想到的可能还是晶体学方法。在结构生物学发展的早期阶段,人们通过将结构一致的蛋白质结成稳定的晶体,并通过对X射线穿过晶体的衍射图谱进行分析,来探讨单一蛋白分子的三维结构与分子构成。然而,尽管X射线能够解析简单的、静态的蛋白分子结构,但在当分子复合物较大,或者具有较不稳定的动态结构时,X射线衍射方法常常相形见绌——除了结晶过程极度困难之外,X射线衍射还只能对静态的结构给以还原,因而常常只能提供非常有限的生物学信息。
冷冻电镜单颗粒分析方法(cryo-EM)通过将生物样品冷冻在极薄的玻璃态冰层中,并通过电子透射的方式对其进行成像,根据中心截面定理进行重构,在很大程度上解决了这一困境。在cryo-EM发展的初期阶段,病毒分子就由于其对称性而较容易获取高分辨率的三维结构而被周正洪教授团队等结构生物学先驱用来作为结构分析的对象。尤其是在2013年的分辨率革命过后,大量的蛋白复合物结构、膜蛋白结构、甚至是动态分子过程都能够在原子分辨率层级上得到还原和解析。而在这篇文章中,科研团队利用成熟的单颗粒挑选和重构方法,获取了多种病毒基因组包装和衣壳组装的中间体外壳及内部的高分辨率细节结构。
虽然Cryo-EM在解决诸多生物大分子结构相关的问题上足够强大,但对生物学家来说,它还有一个重要的不足之处:不能在细胞内部进行。也就是必须经过蛋白纯化的阶段,无法直接“看到”细胞内当下、即刻发生的生物大分子活动。以这次的病毒结构解析为例,若无法对细胞内部正在进行生命活动的原位病毒结构进行解析,而是仅能获得体外充足或提纯的病毒结构,就几乎无法从逻辑上完全说明这一生物过程究竟如何发生。
能够解析原位生物分子结构图景的技术,是被誉为“结构生物学领域下一个突破”的“冷冻电镜断层成像”Cryo-ET。冷冻电镜断层成像技术(cryo-electron tomography,cryo-ET)和子断层图像平均法STA(sub-tomogram average)正在悄然崛起。它通过对单一样品进行旋转,让电子光路通过不同倾斜角度下的同一样品,根据这些角度下的不同成像进行目标结构的三维还原。对原位样品中有单类分子多次重复的情况(如细胞内核糖体、新冠病毒囊膜蛋白),断层成像技术能够将大量重复出现的蛋白所在的子断层图像(sub-tomogram)裁剪出来,并旋转到同一个方向,把所有的该蛋白质的信号叠加起来,最终获得一个高信号、低噪音的蛋白质结构,这也就是STA算法的原理。在STA方法加持下,Cryo-ET的分辨率可达原子级别。
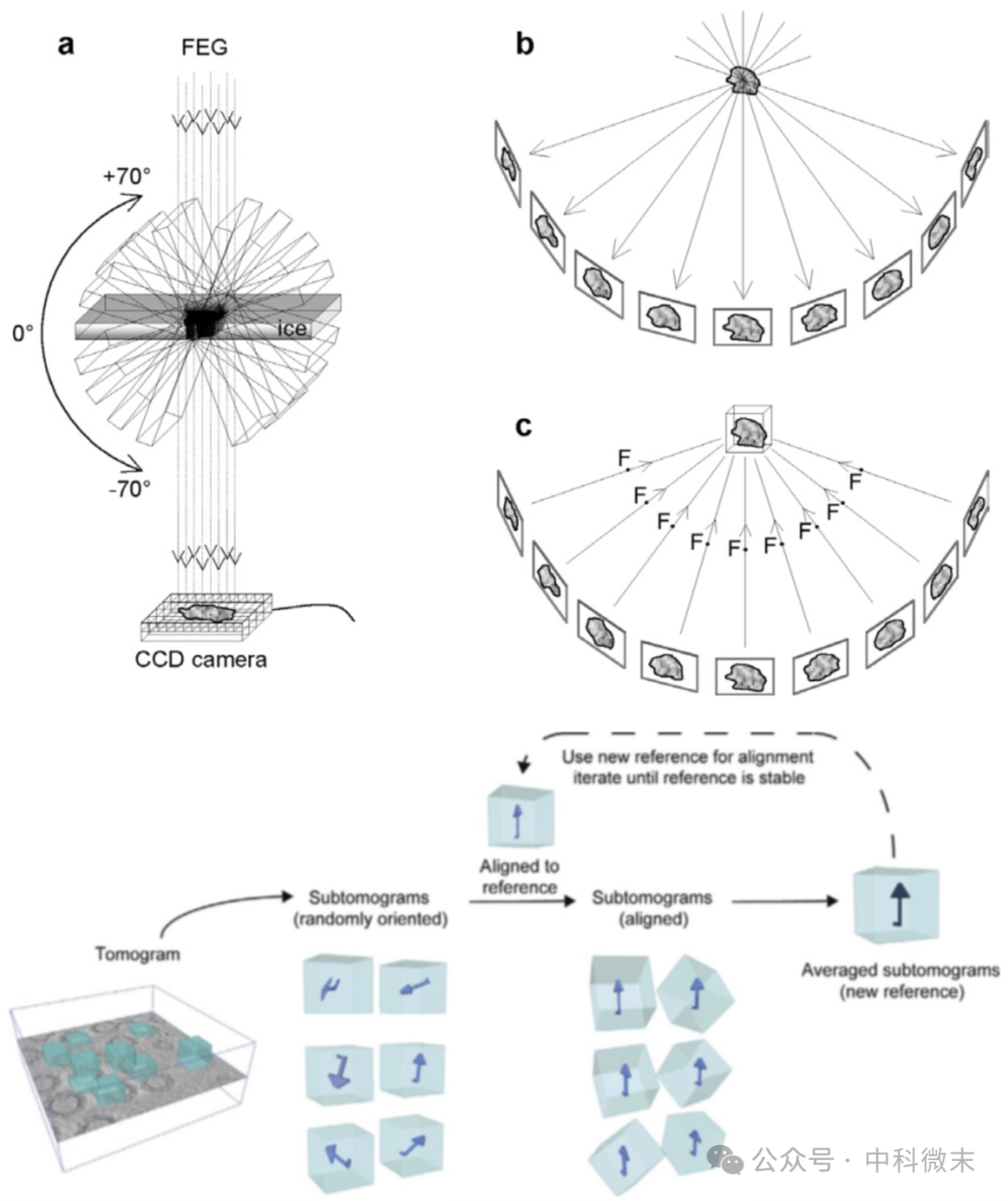
图2: Cryo-ET和STA方法的基本原理
总结而言,Cryo-ET能够将结构生物学导向解析柔性超大分子复合物结构、细胞原位蛋白结构、细胞原位分子复合物乃至细胞器结构等方向,应用范围覆盖蛋白复合物、病毒、细菌、细胞甚至组织,是“名副其实的跨尺度高分辨显微成像利器”。
Cryo-ET对细胞内环境的结构解析尽管功能强大,但分辨率受限。其中最重要的一点就是样品的薄厚——只有冷冻切片的样品足够薄,透射电子才能尽可能有效地进行穿透,尽量避免损失结构信息。20世纪90年代兴起的聚焦离子束切割-扫描电镜成像技术(FIB-SEM)主要应用于半导体行业,21世纪以来才被应用于生命科学来观察细胞或组织内部的结构,是一种高效、快速、自动化的大体积三维成像的方法。而冷冻FIB(Cryo-FIB)将聚焦离子束电镜和冷冻系统结合,减少了离子束对样品的损伤,并且可对液相和离子束敏感的样品进行分析。简单地讲,这一技术利用扫描电子显微镜(SEM)对冷冻的细胞样品表面进行观察,同时使用聚焦离子束(FIB)切除目标之外的多余部分。制备好的样品可以直接转移到Cryo-ET显微镜的镜筒下进行观察,具有损伤小、精度高、集成化的特点。
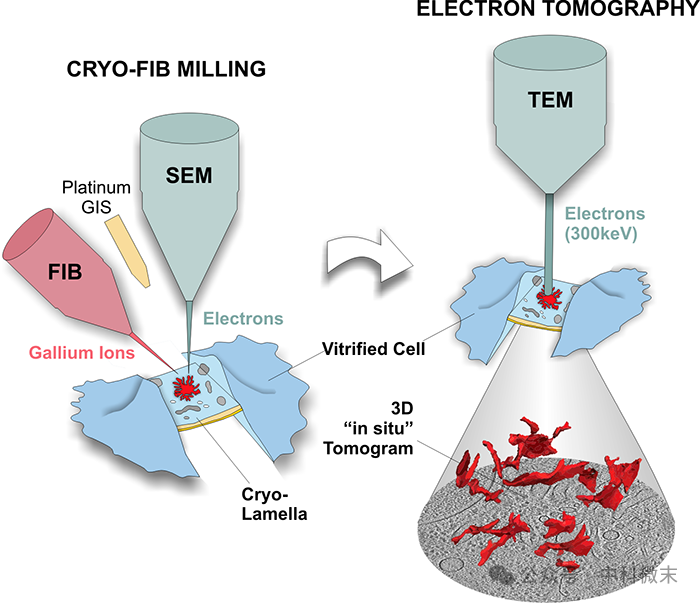
图3: Cryo-FIB技术原理示意图
cryo-FIB切割与cryo-ET的结合在细胞生物学领域具有改变游戏规则的潜力。它可以克服在样品制备方面电子投射的厚度限制问题,同时保证高分辨率和最佳程度的结构保存。cryo-FIB、cryo-ET与STA算法的联手,使结构生物学家能够从字面意义上“打开玻璃化细胞内部的窗户”,以亚原子级别的分辨率对功能性细胞环境进行原位成像。
在这项研究中,研究人员合理运用结构生物学技术,将Cryo-FIB、Cryo-ET和Cryo-EM技术有机结合,充分利用现代结构生物学技术的强大能力,攻克了长久未解的科学问题。
巧妙利用生物学思维还原逻辑关系
——研究人员揭开衣壳包装奥秘
单纯的使用先进技术并非是生物学家的作风。技术已然存在,但对生物学家来说,要获取何种结构以及如何对所得结构进行阐释才是更加关键的问题。
在这篇文章中,研究人员首先将感染的宿主细胞通过cryo-FIB切割减薄为厚度大约200 nm的细胞薄层,然后利用cryo-ET收集原位数据,以分析宿主细胞内不同部位的病毒状态。
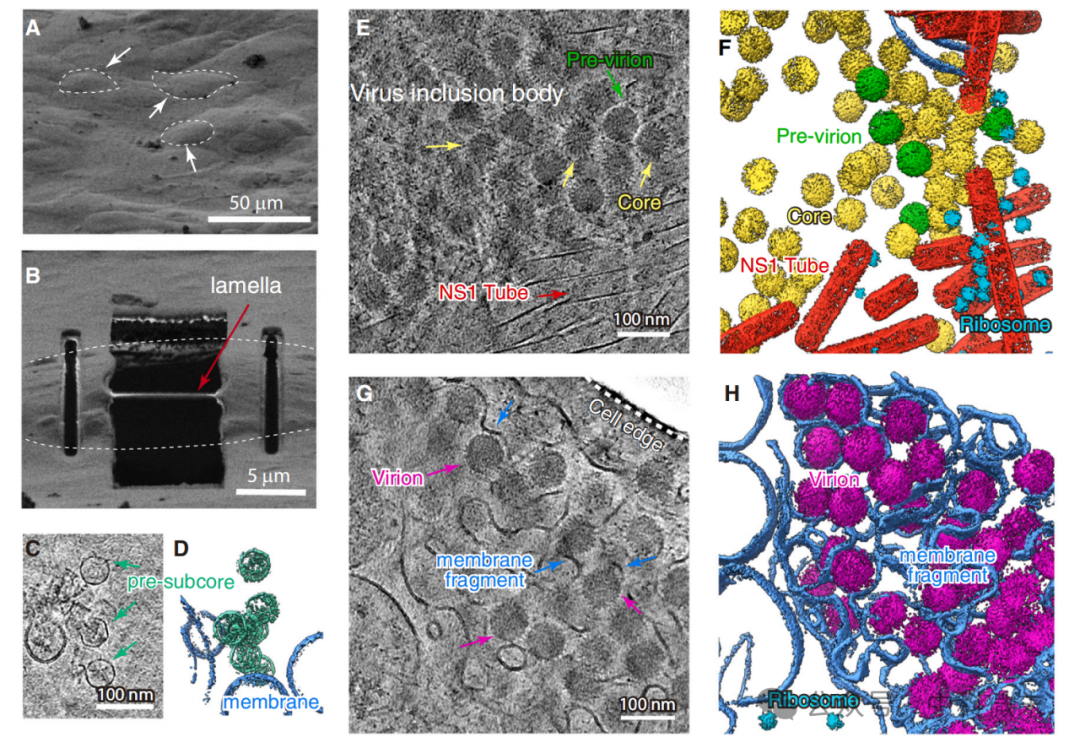
图4:Cryo-ET揭示了原位细胞结构中不同的病毒颗粒及其分布状态
在原位断层成像得到的结构中,研究人员识别了许多病毒颗粒的三维结构以及它们的细胞内分布情况。在原位断层图中存在着多种病毒组装的中间状态,包括散在分布的pre-subcore,和病毒非结构性蛋白NS1聚集在一起形成病毒内聚体(virus inclusion body,VIB)的pre-viron和core,以及作为成熟粒子靠近细胞膜,并影响了细胞膜稳定性的viron。
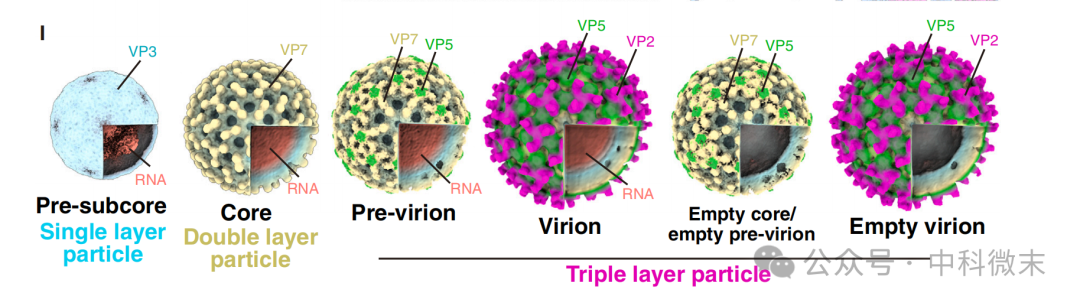
图5: 从原位结构中解析出的不同病毒颗粒结构
通过子断层平均法(STA),研究人员展示了细胞内一共6种病毒颗粒形态。其中有由单层病毒蛋白构成,内含RNA的pre-subcore;有双层蛋白、外层为VP7的core;还有由三层的pre-viron以及进一步搭载了受体结合蛋白VP2的完整病毒颗粒。另外还有两种数量较少的、内部不含RNA的空心颗粒。
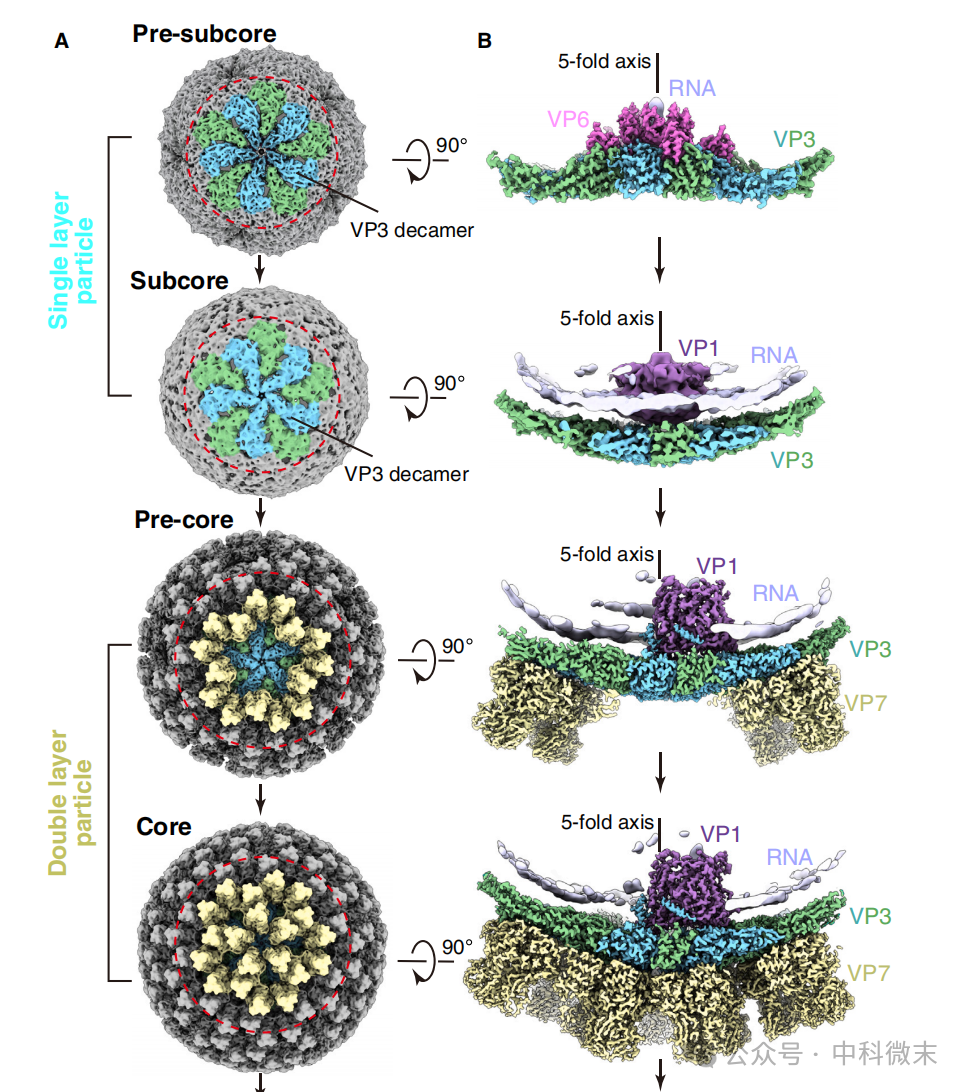
图6: 使用Cryo-EM方法在体外对病毒颗粒进行高分辨率解析
接下来,研究人员又使用Cryo-EM在更高分辨率下解析了从感染细胞中纯化得到的病毒颗粒结构。从同一批感染细胞纯化得到的病毒中,除了上述在细胞原位已经看到的颗粒形态之外,还有一种介于pre-subcore和pre-core之间的“中间结构”,即subcore。
体外解析的pre-subcore结构引发了研究人员的关注。通过特定的冷冻电镜算法,在pre-subcore的单层衣壳内部能够解析出基因组RNA输入蛋白马达VP6的高分辨率三维结构。在五重对称轴周围(也就是病毒ssRNA基因组输入孔的周围),VP6蛋白与VP3衣壳结合,并以五个一组的方式围绕孔径一周。其中,CBD结构域(紫)负责与VP3结合,而RBD结构域(粉)和VP3蛋白一起,构成了基因组RNA输入的“静电通道”。
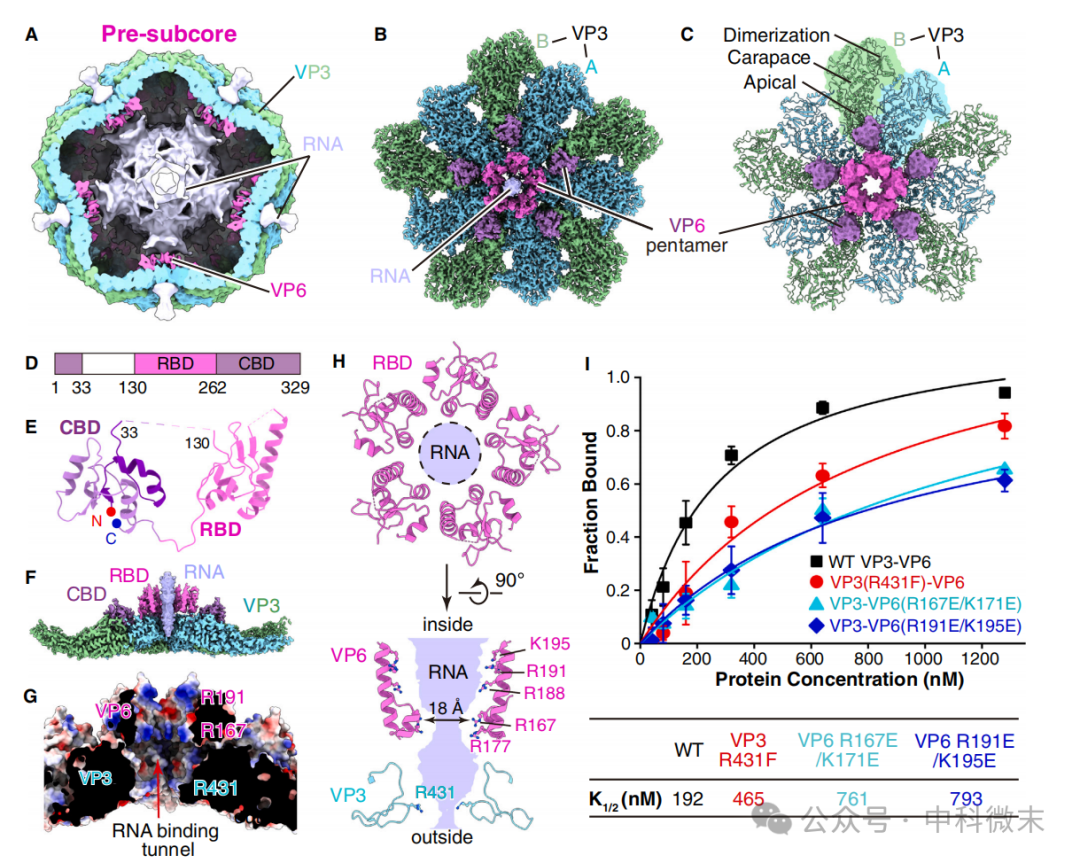
图7: 体外的高分辨率pre-subcore病毒颗粒结构
生化实验证明,这一静电通道对RNA的输入至关重要;同时通道内部充满正电荷的氨基酸相互聚拢的情况表明,RNA的存在应当对通道本身结构稳定性的维持起着至关重要的作用。
在纯化得到的混合蛋白样本中,研究人员还在冷冻电镜“挑颗粒”的过程中发现了一种结构奇怪的“四聚物”,它们由内层衣壳蛋白VP3组成。在这个VP3四聚体上也结合了VP6蛋白分子,但却只能看到其CBD结构域而完全看不到RNA接触结构域。这实际上意味着在不与RNA分子结合的情况下,VP6分子本身结构并不十分稳定。另外,在内部不含RNA的空壳病毒颗粒中,也无法解析出VP6分子的结构。在生化验证中,研究人员发现,在人工添加ssRNA片段或将通道接触面氨基酸突变为不带电氨基酸的情况下,衣壳成功组装的概率有所提升。这些说明RNA的确对衣壳组装的稳定性意义重大。
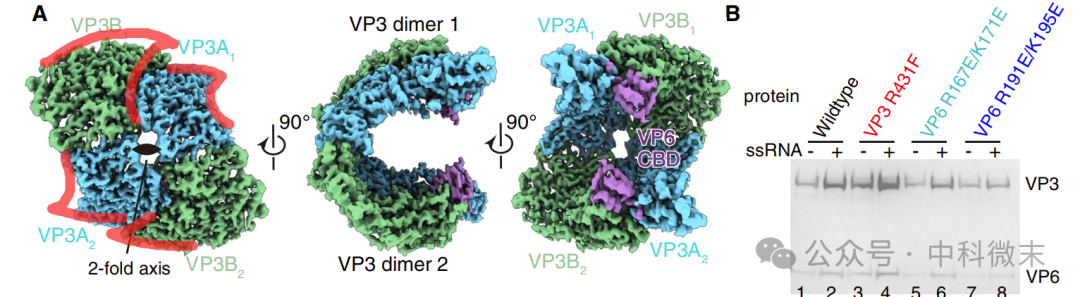
图8: “奇怪的”病毒VP3内部衣壳蛋白四聚体
添加长达40nt的ssRNA后,人们发现VP3和VP6能够在体外组成一种“星形”的star-subcore,这一结构和其他一些同类病毒的组装前体颇为类似。与pre-subcore相比,二者具有相同的蛋白成分,但star在五重对称轴附近的结构更加“内陷”,整体内部空间更小。研究人员通过对结构的解析进一步发现,star-subcore实际上就是以之前解析出的VP3四聚体为单位组装而成的。
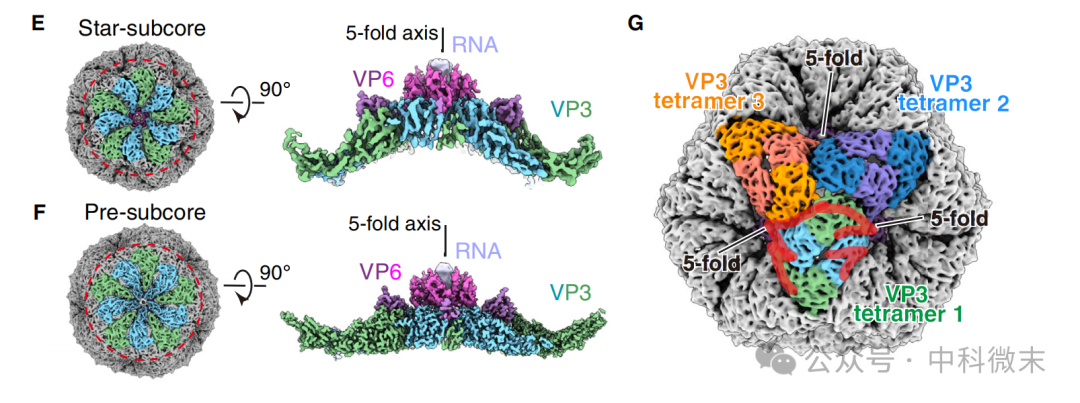
图9: star-subcore的三维结构解析,和与pre-subcore的对比
而在下一阶段,也就是subcore颗粒的结构中,可以看到subcore的衣壳蛋白相比之前进一步向外扩展,已经成了近乎圆球的形状。在VP3外扩进一步增加内部空间的同时,也介导了RNA聚合酶VP1蛋白结合在之前VP6所在的位置上,将VP6替代下来。在subcore颗粒的内部已经能够看到比较完整且分层排布的基因组RNA结构,提示此时从ssRNA到dsRNA的复制过程基本已经完成。
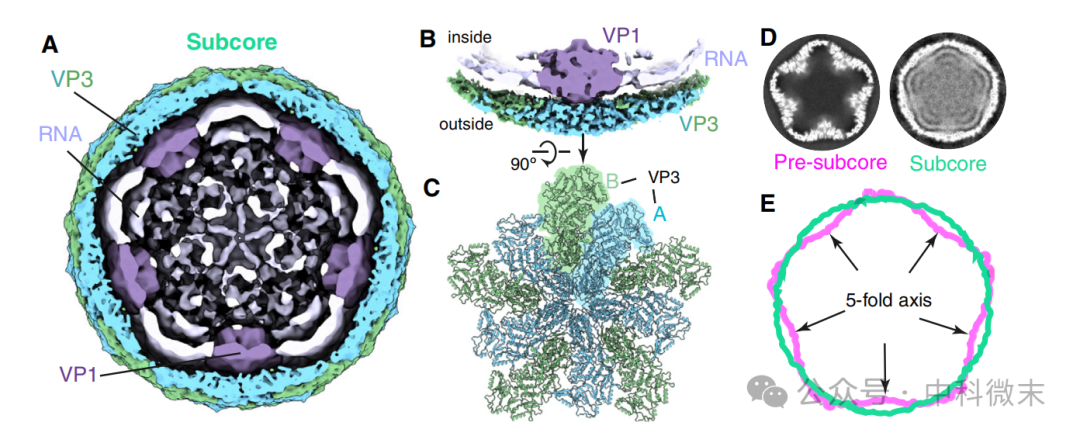
图10: subcore病毒颗粒结构
综上所述,周正洪教授团队通过cryo-ET与cryo-EM方法,一共解析出了11种不同病毒颗粒组装的中间形态。其中在cryo-ET成像中因其分布的特殊性(在VIB外部)而首次发现,并在cryo-EM成像中进一步以高分辨率解析得到结构的pre-subcore粒子,成为了阐明dsRNA病毒衣壳组装真实过程的关键结构。RNA对于内层衣壳的组装至关重要,符合类似ssRNA病毒的“共组装模型”;而RNA通过孔道逐渐输入到衣壳中,伴随着衣壳的逐渐扩张,又符合类似dsDNA病毒的“填充模型”。事实证明,dsRNA病毒的组装综合了以上两种病毒的不同特征。基于以上分析,周正洪教授团队最终还原了dsRNA病毒组装的生物学过程:
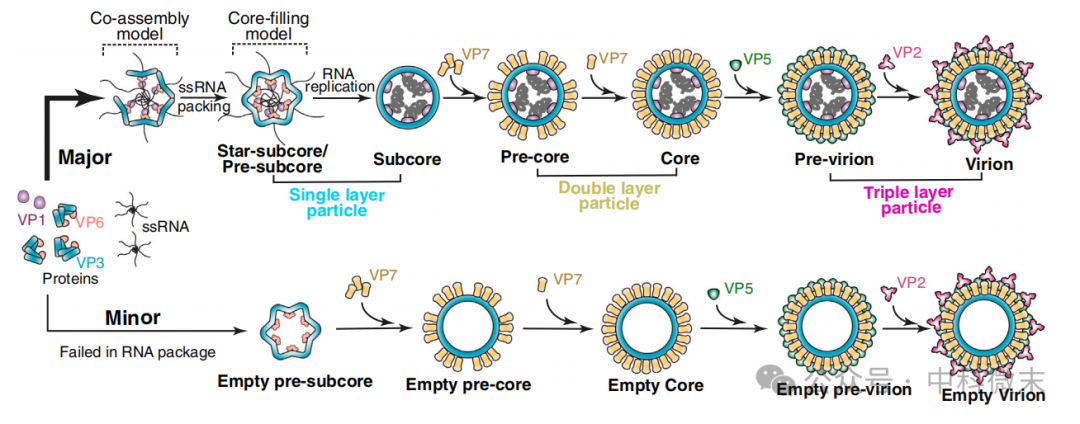
首先,10条ssRNA基因组互相缠结,形成RNA多聚体,以便完整准确的包装到衣壳中;作为四聚体的VP3蛋白在ssRNA的帮助下,与VP6、VP1一起围绕RNA进行组装,拼接成完整的最内层衣壳;
然后,剩余的RNA部分留在外面,通过VP6逐渐输入到star-subcore的内部,随着内部RNA的填充,star-subcore开始初步外扩形成pre-subcore;
随着RNA的另一条链被VP1蛋白复制出来,pre-subcore进一步外扩,形成圆球形的subcore。在细胞内VIB区域中,VP7、VP5和VP2蛋白以特定形式依次组装到衣壳表面,最终形成完整的病毒粒子;
完整病毒粒子依靠表面的VP2与非结构蛋白NS3互作,与细胞膜相接触,并最终脱离细胞。
总结而言,周正洪教授团队在对dsRNA病毒的研究中,立足生物学关系推理,结合多项高精尖结构生物学技术,解析了dsRNA病毒在宿主细胞内复制组装的机理,提出了BTV病毒组装的“二重性”模型。这一模型解答了重要的生物学问题,为其他类型病毒的研究提供了参照,也为相应抗病毒疫苗和药物的开发提供可宝贵的科学依据。
目前,全球范围内能够使用冷冻电子断层扫描Cryo-ET这一强大技术的科技公司可谓凤毛麟角,而中科微末团队在Cryo-ET、Cryo-EM、Micro-ED等多项结构生物学高精尖技术方面已经具备成熟的结构解析经验和系统性的实验方案。在细胞原位以高分辨率解析蛋白质的三维结构,才是真正解析了蛋白质的细胞内状态,才是对其生物学机制的真正研究。多篇CNS综述已经指出,Cryo-ET技术的发展和运用决定了结构细胞生物学界,乃至整个生物医药界的未来。
中科微末团队在生物大分子三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
内容中包含的图片若涉及版权问题,请及时与我们联系删除





评论
沙发等你来抢