

AlphaFold3真的来了!
美东时间5月8日, Google DeepMind 和 Isomorphic Labs 发布了新一代AlphaFold3。这是一种革命性模型,用于预测蛋白质、DNA、RNA、小分子等的几乎所有生物分子结构和相互作用。
与现有的预测方法相比,AlphaFold3至少有 50% 的改进,对于一些重要的相互作用类别,预测精度提高了一倍。
DeepMind 表示,该工具提供了比以前可用的任何工具更细致、更动态的分子相互作用描述。这一进展可能有助于加速药物发现和其他科学研究。
目前,这项里程碑的研究工作已经发表在《自然》杂志上,可能会极大地加速生物学研究。

 AlphaFold3 如何揭示生命分子
AlphaFold3 如何揭示生命分子
此次AlphaFold3建立在AlphaFold2的基础上,AlphaFold2于2020年发布,从本质上解决了从氨基酸结构预测蛋白质三维结构的问题。
而AlphaFold 3 更进一步,预测几乎所有生物分子的结构并对这些分子之间的相互作用进行建模,也就是说,AlphaFold 3 标志着单个系统首次能够以最先进的性能预测几乎所有分子类型之间的相互作用。
AlphaFold3是一个复杂的深度学习模型,相较于AlphaFold2做了不少升级,一大亮点就是引入了扩散模型,该模型也被用于OpenAI的Sora、DELL3这样的通用图像大模型。
Pairformer 模块:AF3 引入了一个新的 Pairformer 模块,它取代了 AlphaFold 2 中的 Evoformer,用于处理成对表示和单一表示,而不使用此前的氨基酸多序列比对(MSA)表示。
Diffusion 模块:AF3 使用直接预测原始原子坐标的 Diffusion 模块,直接在原子上扩散使 AlphaFold3 能够处理化学修饰等,而不是此前AlphaFold2在氨基酸和旋转角(torsion angles)上的框架。
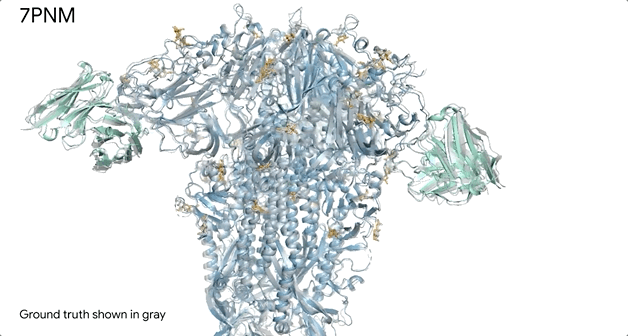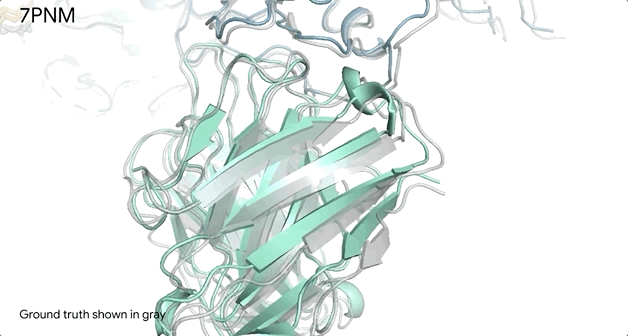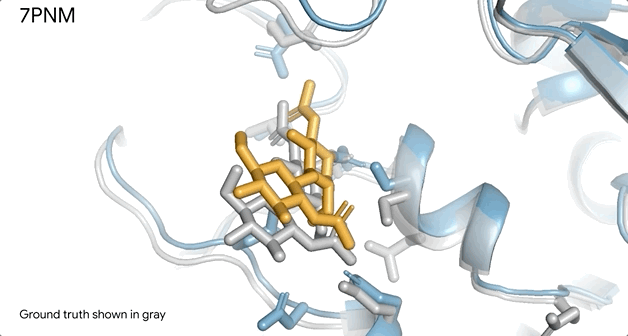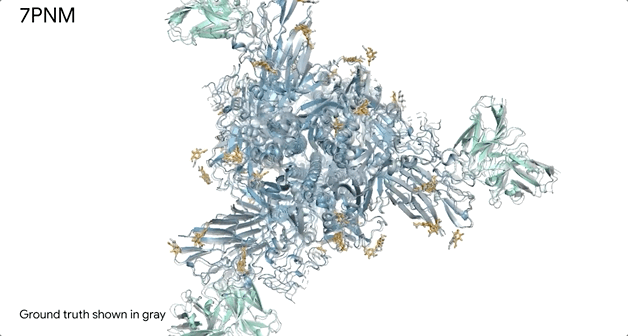
例如AlphaFold对普通感冒病毒Spike蛋白(蓝色)的和抗体(绿色)与单糖的相互作用时候的结构预测,它几乎和实验室得到的结果精准匹配(灰色部分)。
对蛋白质和DNA结合的分子复合物(7R6R - DNA 结合蛋白)进行预测,它的预测结果与实验室测试得出的真实结构几乎一致。
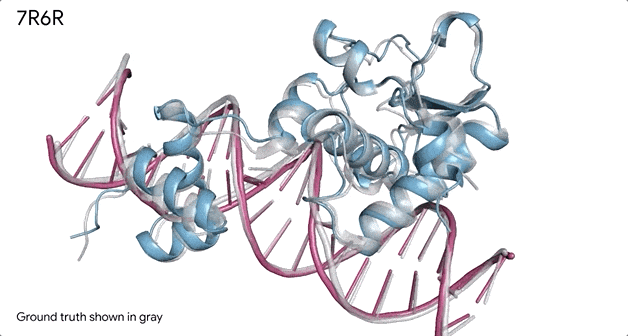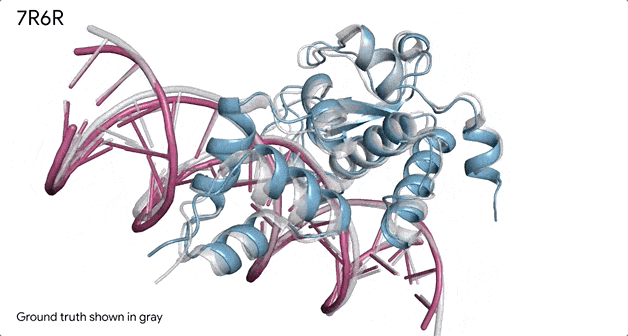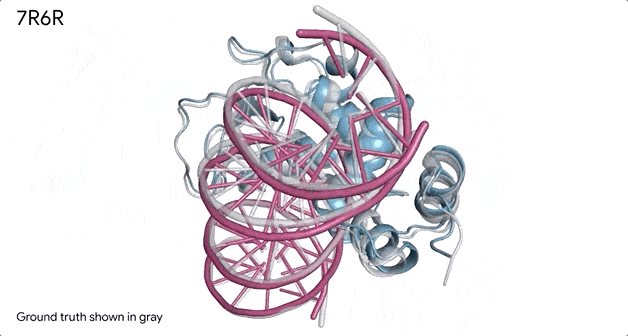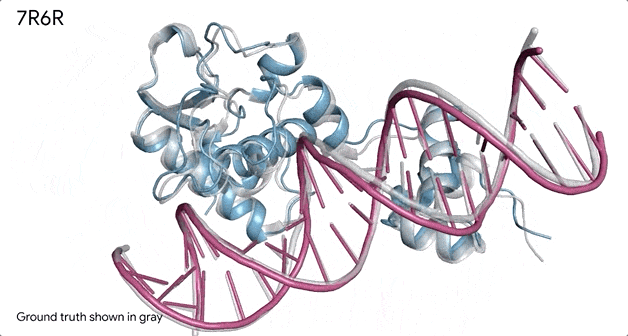
AlphaFold 3 的另一个重要功能是它能够为其预测提供置信度分数。这意味着该系统不仅可以生成3D 结构,还可以估计这些预测的准确度。
研究人员来说预测准确度也是很有价值的信息,因为它可以帮助他们确定要重点关注哪些预测以进行进一步的实验验证。
这样的效果,蛋白质预测领域泰斗David Baker 对AlphaFold 3给出了高度评价“AlphaFold3 的结构预测性能非常令人印象深刻。”
并表示这比他的团队开发的 RoseTTAFold All-Atom 更好。
 剑指药物发现 与礼来诺华开展合作
剑指药物发现 与礼来诺华开展合作
相较于此前发布的AlphaFold2,更新一版本的AlphaFold3对于药物研发的影响力也将更大。
“AlphaFold 2系统只知道氨基酸,因此它对生物制药的效用非常有限,” 哥伦比亚大学系统生物学助理教授Mohammed AlQuraishi说。“但现在,该系统原则上可以预测药物与蛋白质结合的位置。
据 DeepMind 称,DeepMind 的药物发现子公司 Isomorphic Labs 已经在使用该模型来实现药物研发,并且和制药公司合作,尝试开发新的疾病治疗方法。
Isomorphic Labs于2021年11月从DeepMind拆分而来,由DeepMind 创始人 Demis Hassabis担任首席执行官。
据悉,Isomorphic Labs的药物发现团队已经在使用AlphaFold 3进行基于结构的药物理性设计,包括接近新的疾病靶点,以及通过AI制药的新方法来追求之前的不可成药靶点。
为了证明 AlphaFold3基于合理结构的药物设计的潜力,该团队研究了免疫检查点蛋白TIM-3,在 2021年发表后被确定为癌症免疫治疗的潜在点。
在Isomorphic Labs团队发文之前,蛋白质数据库中不存在 TIM-3的小分子结合晶体结构,并且这些结构不在 AlphaFold3的训练集中。
团队使用 AlphaFold3评估了这个蛋白,在没有向AlphaFold 3提供任何关于姿势、结构或口袋的额外信息的情况下,预测的结构与己发表的实验结构一致。
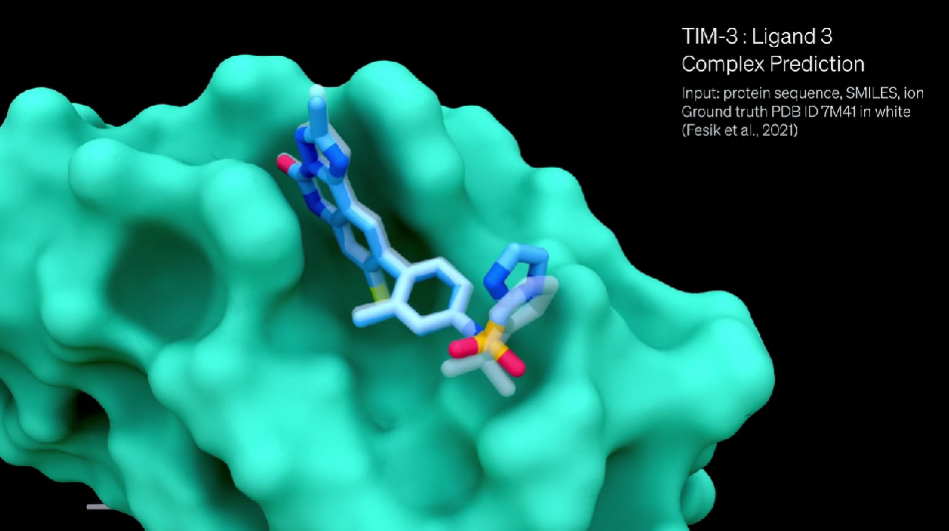
通过这个例子,AlphaFold 3证明了它可以准确地描述药物分子结构设计的进展。
目前该公司已分别与礼来和诺华开展了药物研发合作,分别获得了4500万美元与3750万美元的预付款,这两笔交易涉及到多靶点的小分子药物。
仅从这两次合作中,Isomorphic Labs就有资格获得高达30亿美元的基于业绩的里程碑付款。
据这位高管称,两家企业合作推出的第一批药物可能会“在未来两年内”到达。
 没开源,且使用有限制
没开源,且使用有限制
Hassabis 表示,对于 AlphaFold 3,目前没有计划发布完整代码。
这也是受到很多科学家们诟病的地方,毕竟AlphaFold2是完全开源,这一举动极大地促进了计算蛋白质的进步。
“没有代码的计算论文不应该被接受,”加州大学旧金山分校弗雷泽实验室的结构和计算生物学家Stephanie Wankowicz在社交媒体上发帖说。“此外,访问受到限制阻碍了开放科学的进步。”
好在DeepMind为该模型发布了一个名为AlphaFold Server 的公共接口,该接口对可以进行实验的分子施加了限制,并且只能用于非商业目的。
不过,使用这个模块也是有限制的,科学家对AlphaFold3每天只能进行10次预测,而且无法获得可能与药物结合的蛋白质结构。
对于药物研发而言,预测分子如何相互作用是一件非常重要的事情,因为大多数药物的作用原理是与目标蛋白质结合。
也就是说,DeepMind出于商业考量放弃了科学开源精神,转而让其创办的 Isomorphic Labs 和礼来、诺华等顶级制药公司达成了价值30亿美元的合作。
如今,全球科学家已经紧锣密鼓地使用AlphaFold3进行各种基准测试。
例如有科学家用AlphaFold3识别MutH 或 MutL 的相互作用位点,得到的结果和试验完全一致,而他博士论文中的绝大部分精力耗费在这上面,这位科学家称,AlphaFold3太疯狂了!
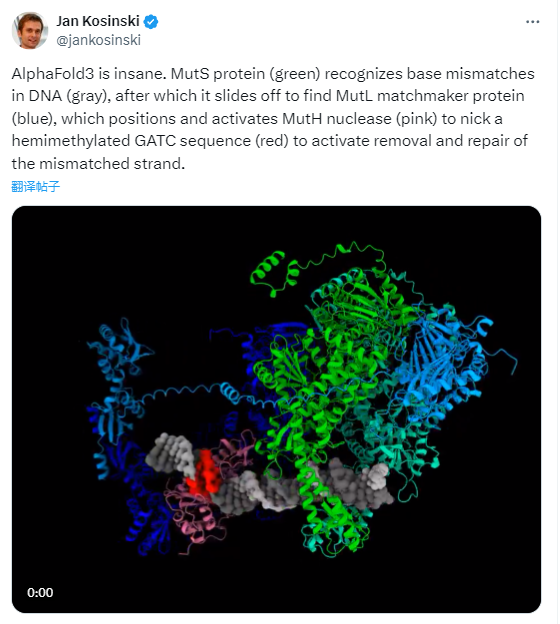
但无论开源与否,AlphaFold 3 的开发都代表着AI计算模型对生物分子结构和相互作用理解的一个重要里程碑。
通过提供复杂生物系统的精确 3D 模型,它为药物发现、蛋白质工程和生命科学的基础研究开辟了新的可能性。
参考链接:
https://blog.google/technology/ai/google-deepmind-isomorphic-alphafold-3-ai-model/#life-molecules
https://www.isomorphiclabs.com/articles/rational-drug-design-with-alphafold-3
—The End—
推荐阅读

内容中包含的图片若涉及版权问题,请及时与我们联系删除





评论
沙发等你来抢