DRUGAI
今天为大家介绍的是来自杨光富团队的一篇论文。蛋白质-蛋白质相互作用(PPIs)对于多种细胞性过程至关重要,为药物靶点发现提供了一个有前景的途径。PPIs的特征是多层次的复杂性:在蛋白质层面,可以利用相互作用网络来识别潜在的靶点;而在残基层面,可以利用单个PPIs的相互作用细节来检查一个靶点的可药性。在通过多层次PPI相关的计算方法进行靶点发现方面,已经取得了巨大的进展,但这些资源尚未得到充分讨论。在这里,作者系统地调查了用于识别和评估潜在药物靶点的生物信息学工具,检查它们的特性、限制和应用。这项工作将帮助将更广泛的蛋白质到网络的上下文与详细的结合机制分析相结合,以支持药物靶点的发现。

药物靶点在现代药物开发中至关重要,新靶点的发现有可能将药物开发失败率降低48%。PPIs在大多数细胞过程中发挥关键作用,其中异常的PPIs与各种疾病相关,因此具有病理学意义的PPIs具有成为药物靶点的潜力。Fr-PPIChem是一个化合物库,显示出极大的PPI靶点发现潜力,在与未富集PPI抑制剂的库相比时显示出46倍的活性率提升。因此,研究PPI作为药物靶点至关重要。PPI展示了多层次的组织结构,为药物靶点发现提供了宝贵的见解。在蛋白质层面,PPI网络(PPINs)以蛋白质为节点,它们之间的关系是边模拟了PPI的复杂性质。蛋白质层面的分析有助于通过评估它们在网络中的重要性来识别靶点,而残基层面的研究关注结合位点和亲和力,并提供了对靶点可行性的见解(见图1a)。多层次研究涉及使用蛋白质层面的分析来选择特定的相互作用进行研究,然后使用残基层面的分析来阐明它们的结合细节以评估其可药性,这强调PPIs的多层次性质的方法对于药物靶点的发现至关重要。
在这里,作者对不同规模的工具进行系统评估,这些工具用于发现与PPIs相关的药物靶点(见图1b)。最初,作者强调了PPIs的多层次组织结构,为药物靶点发现提供了独特的洞察。此外,作者总结了网络、节点注释、结合位点、亲和力以及综合数据库。这些数据库促进了计算机药物靶点发现工具的发展。作者讨论了计算方法的最新进展,探索它们的适用性并讨论它们的局限性。最后,作者提供了药物靶点研究的案例研究,突出了这些工具的实用性。这项工作旨在帮助相关领域的研究人员使用生物信息学工具,将蛋白质到网络的上下文和残基层面的机制整合起来,以识别和验证潜在的药物靶点。
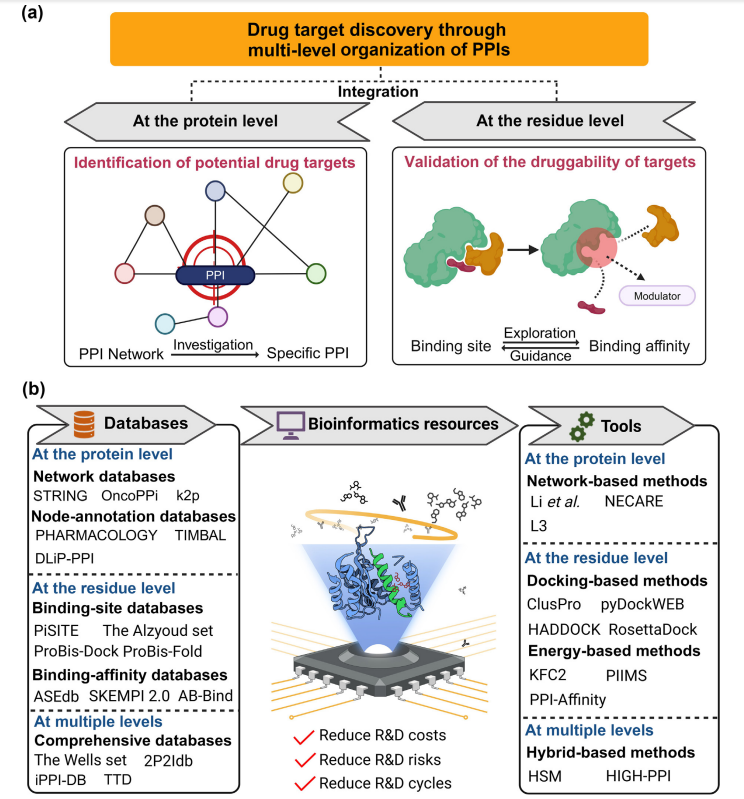
图 1
数据库
实验方法学和信息技术的进步促进了与PPI相关的数据库的发展。这些数据库包含了关于蛋白质相互作用的多样化信息,从蛋白质层面的网络和节点注释到残基层面的个别PPIs的相互作用细节。这些综合数据库包含了作为补充的多层次数据。在这里,作者提供了对这些数据库的深入调查和比较,包括描述、数据量和功能等详细信息。
蛋白质层面的网络数据库:这些数据库分为同构和异构两类,同构数据库如STRING侧重于基于PPI数据生成的统一关系网络,而异构数据库结合了额外的组学数据,增强了生物网络的复杂性。例如,OncoPPi和konnect2prot等数据库通过整合多方面的生物信息,提供了对特定蛋白质相互作用和功能的深入了解,这对于识别和优化药物靶点尤为重要。
蛋白质层面的节点注释数据库:这些数据库分为通用和特定两种类型,旨在通过注释和提供药物信息来加速对药物靶点的了解。PHARMACOLOGY等通用数据库提供了广泛的生物和药物数据,而专门的数据库如TIMBAL和DLiP-PPI则专注于PPI靶点和相关化合物,提供更专业的信息和工具,如自动化数据提取和药物类似性筛选,帮助科学家深入理解和开发PPI相关的药物靶点。
残基层面的结合位点数据库:这些数据库分为两种主要类型:收集数据库和评估数据库。PiSITE是一个例子,它通过分析不同的PDB条目来识别蛋白质链上的结合位点。而ProBiS-Dock和ProBiS-Fold则提供了更高级的功能,使用ProBiS算法分析蛋白质表面的特征,寻找并评估结合位点的可药性。这些工具通过提供大量的结合位点数据和高级分析功能,帮助研究者更有效地识别和评估药物靶点,增强了药物开发的可能性。
残基层面的结合亲和力数据库:这些数据库既包括如ASEdb和SKEMPI 2.0等通用数据库(其专注于收集丙氨酸突变和各种突变对PPI结合能量和动力学的影响),也包括如AB-Bind等特定数据库(其专门涉及抗原-抗体相互作用)。这些资源不仅有助于科学家评估靶点的可药性,还提供了深入了解结合位点如何在分子层面上影响药物设计的重要数据。
全面的多层次数据库:这些数据库分为以残基为中心的和集成的数据库。以残基为中心的数据库如2P2Idb专注于提供具体的PPI靶点的结合亲和力和结构参数,还包括高级的界面分析工具。而集成数据库如iPPI-DB和TTD提供关于靶点的空间结构、广泛的PPI网络信息以及它们的可药性和化学特性,为研究人员在药物开发和靶点验证中提供了重要资源。
数据库的局限:PPI相关的多层次数据库在药物靶点开发中起到了关键作用,但它们面临着包括数据过时、访问难、数据不平衡、负样本缺乏以及注释错误等多方面的挑战。这些问题不仅影响数据的质量和可用性,还限制了数据库的广泛应用。此外,结合位点和结合亲和力数据库在准确描述PPIs的动态特性以及多样化突变的效应上也存在局限。为了提高这些数据库的实用性和准确性,需要更多的手工策划内容、改进数据集成方法和增强用户界面的功能性。
计算工具
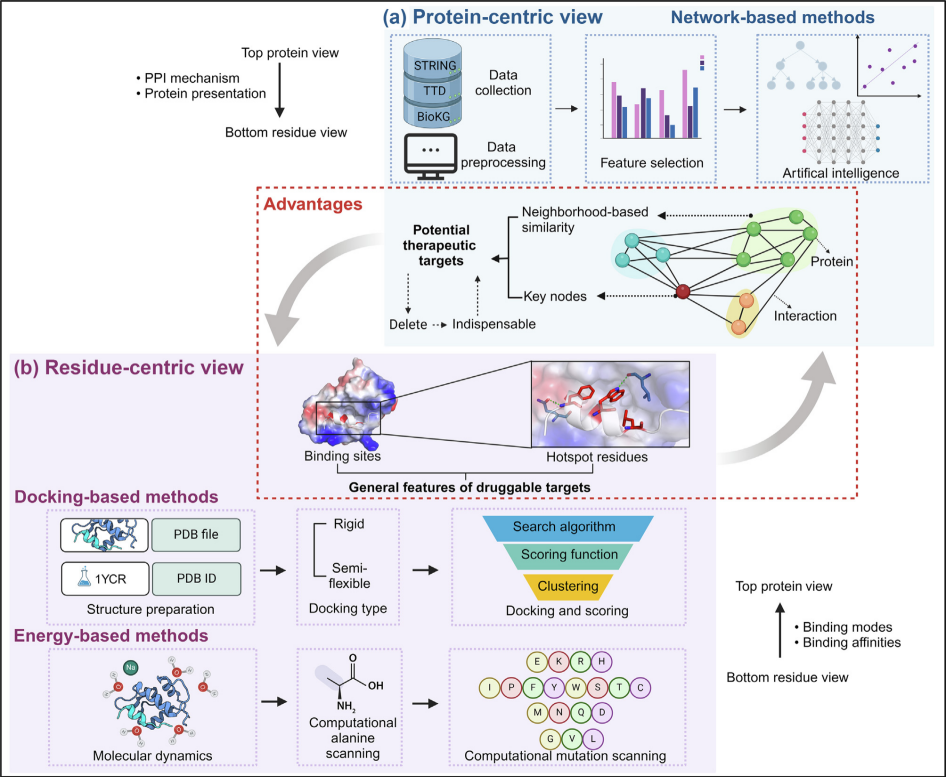
图 2
药物开发中的一个关键阶段是靶点的识别和验证。传统的靶点识别实验方法通常耗时且成本高昂,这促使人们采用计算工具作为药物靶点筛选的有效替代方案。在这里,作者提供了对这些工具的深入调查和比较,包括描述、模型算法和性能等详细信息。
蛋白质层面上的基于网络的方法分为同构和异构方法来识别和预测药物靶点(见图2a)。同构方法,如Li等人和L3所用的方法,通过图论和基于路径的网络模型来分析和预测PPIs显示出高准确性。而异构方法,如NECARE所采用的,结合了多组学数据和知识图谱,能够更全面地理解基因之间的复杂关系,已成功识别多个潜在的药物靶点。
残基层面上的基于对接的方法通过利用靶点的三维结构评估配体的结构和化学兼容性,从而探索其可药性。本节讨论的如pyDockWEB、ClusPro、HADDOCK和RosettaDock等刚性和半柔性对接工具(见图2b),通过CAPRI评估展示了它们在PPI靶点预测中的性能。刚性方法快速但可能缺乏必要的灵活性,而半柔性方法通过引入额外的实验约束和算法,提供了更高精度的预测。
残基层面上的基于能量的方法利用结合界面上的热点来深入了解PPIs的驱动力,为识别和优化热点提供了有力的计算工具。这包括利用支持向量机对热点进行准确分类的KFC2和应用分子动力学模拟进行原位突变扫描的PIIMS,以及评估结合亲和力的PPI-Affinity(见图2b)。这些工具不仅帮助预测和识别PPI界面上的关键热点,还可通过突变和筛选优化PPI靶点的药物设计和亲和力。
多层次上的混合方法结合网络分析和残基层面的详细研究,用于识别和优化药物靶点。通过生物网络识别潜在靶点,然后再通过分析关键残基来评估其可药性,其优点如图2中的红色虚线框所示。例如,HSM方法强调了弱PPIs的结构和亲和力,而HIGH-PPI模型则利用图神经网络来综合残基和蛋白质层面的数据,提高预测的精确性。
计算工具在分析PPIs及其潜在的药物靶点时显示出了显著的潜力,但它们也面临一些技术和实用性挑战。基于网络的工具通常忽视了残基级别的详细相互作用,而基于对接的工具需要提高评分函数的准确性并考虑水分子和蛋白质灵活性的影响。基于能量的方法需要更细致地处理自由状态的蛋白和溶剂效应,而混合方法需要更多的在线实现和简化操作界面。通过持续改进这些工具和技术,可以提高它们在药物发现中的有效性和准确性。
案例研究
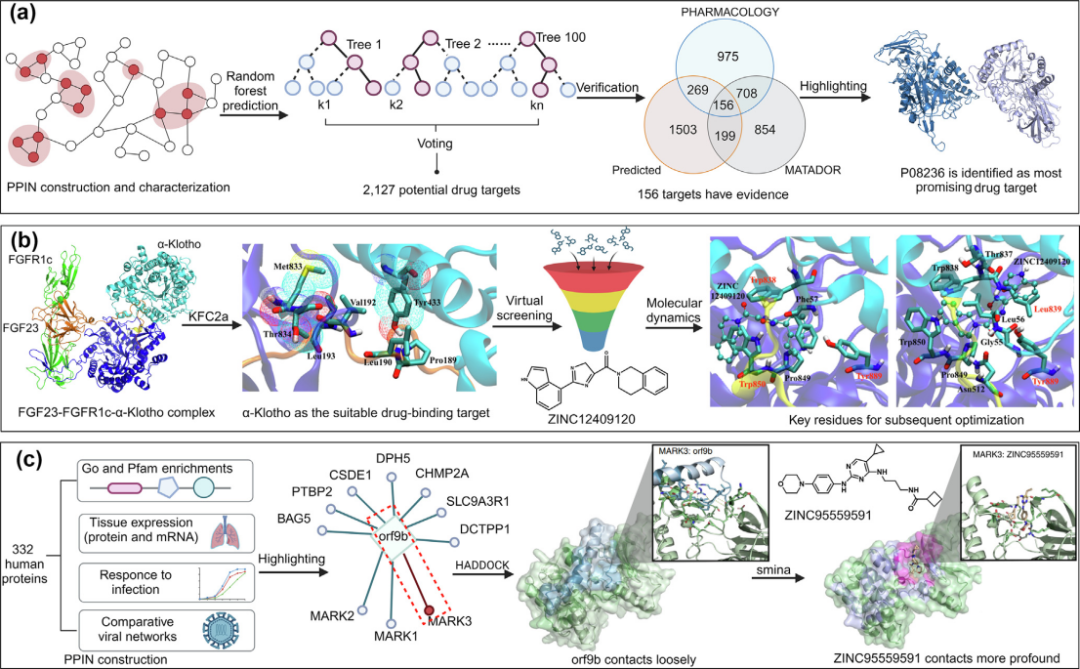
图 3
通过利用PPINs中的拓扑特征,Li等人的研究成功利用RF模型识别了多个潜在药物靶点,其中P08236作为治疗粘多糖症的最有希望的靶点。模型基于从大型蛋白数据库中得到的证据,确认了这些靶点的可信度,并通过额外的研究进一步验证了P08236与粘多糖症的联系。这项工作不仅突显了计算方法在药物靶点识别中的有效性,还展示了如何通过网络分析对比靶蛋白和非靶蛋白(见图3a),从而为粘多糖症等疾病的治疗提供了新的靶点。
另一项研究验证了FGF23-FGFR-α-Klotho相互作用作为抗低磷血症的潜在药物靶点。通过应用KFC2a识别热点,然后通过虚拟筛选方法从数百万化合物中筛选出具有高结合亲和力的候选物。此外,实验评估和分子动力学模拟进一步验证了这些化合物抑制FGF23相关路径的能力。这不仅增进了对FGF23-FGFR-α-Klotho复合体结构的理解,还为其他PPI家族的基于结构的药物靶点发现提供了一个框架(见图3b)。
第三项研究通过多层面的方法探索了orf9b与MARK3的相互作用,作为一种潜在的抗COVID-19药物靶点。通过结构互作网络的创建和高精度对接分析,研究团队预测了ZINC95559591阻断orf9b与MARK3相互作用的潜力,并通过实验验证了其抑制效果(见图3c)。此外,该研究利用药物再利用策略,不仅增强了对病毒与宿主相互作用机制的理解,还为发现新的药物靶点提供了新途径,展示了结构生物学在现代药物发现中的重要应用。
编译|于洲
审稿|王建民
参考资料
Liu J X, Zhang X, Huang Y Q, et al. Multi-level bioinformatics resources support drug target discovery of protein–protein interactions[J]. Drug Discovery Today, 2024: 103979.
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢