

6月10日,美国食品和药物管理局(FDA)特殊委员会以11比0全票同意礼来β淀粉样蛋白(Aβ)抗体Donanemab用于治疗早期阿尔茨海默病(AD)患者。
这也是继2023年重磅药物卫材Leqembi获批后,AD新药再次轰动医药圈。
根据世界卫生组织《2023年世界社会报告》数据显示,截至2018年全球约3310万人患有阿尔茨海默症,2050年这一数字将增至2.42亿。
但由于发病机制尚无定论,AD 药物开发难度较大,1998-2017 年,AD 药物的研发成功率仅有 2.7%。
尽管近年来医学界在靶向Aβ抗体的生产和药物开发取得了进步,但现有的AD疗法仍然存在诸多问题。
如胆碱酯酶抑制剂等传统药物的疗效普遍不足,只能短期控制症状,多数仅能延缓进程;而Aβ抗体药物则存在脑水肿(ARIA-E)及脑出血(ARIA-H)风险。
越是复杂的疾病,能帮助确定治疗靶点并优化先导化合物的工具价值越高。
无论诊断筛查、药物再利用还是新靶点发现,人工智能和机器学习已经为在神经退行性疾病药物研发中大展身手做好了准备。

AI靶点发现 中国企业一马当先
通过分析大量的分子、结构和临床数据,AI药企在积极地寻找神经退行性疾病的新治疗方案和联合疗法。
而中国AI药企英矽智能是其中的佼佼者。
2023年,英矽智能与剑桥大学合作在《美国国家科学院院刊》(PNAS)上发表了题为:Multiomic prediction of therapeutic targets for human diseases associated with protein phase separation的论文。
二者运用英矽智能自主研发的靶点识别引擎PandaOmics工具和剑桥大学开发的FuzDrop方法,确定神经退行性疾病(特别是AD)的新药物靶点。

用于多组学预测与PPS相关的人类疾病治疗靶点的工作流程
该研究对人类样本数据进行了大规模的多组学研究,量化了蛋白质相分离在调控与疾病相关的各种病理过程中的影响。
对具有较高 PandaOmics 和 FuzDrop 评分的候选蛋白进行优先排序,并生成了与蛋白质相分离过程失调相关的潜在疾病靶点列表。
其中AD细胞模型的实验最终证实了三个预测靶点:MARCKS、CAMKK2和p62,该实验还发现了与相分离失调有关的蛋白质,这对疾病病理学至关重要。

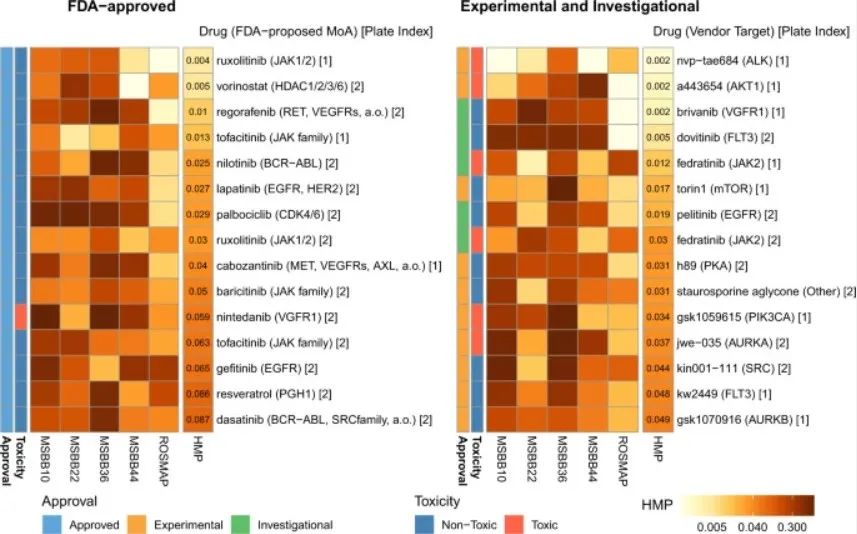
药物再利用:AI发现了15款潜力药物
—The End—
推荐阅读



内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢