
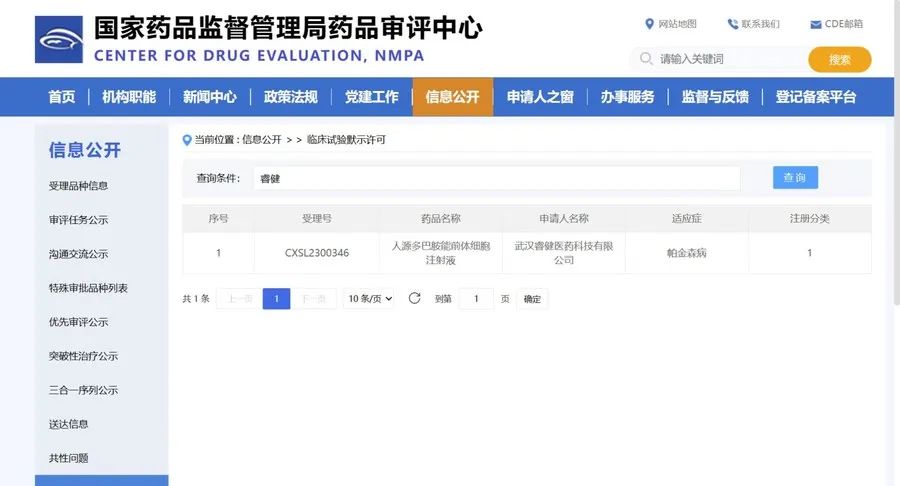
6月20日,美国食品药品监督管理局(FDA)正式批准了睿健医药帕金森管线NouvNeu001的IND申请。作为帕金森领域中全球首个进入临床阶段的基于化学诱导的通用型细胞治疗产品,睿健医药的NouvNeu001“临床I-II期联合临床”研究已在2023年8月通过国家药品监督管理局(NMPA)批准,并在临床Ⅰ期实验中取得了积极的安全性和疗效数据。此次被FDA获批开展临床研究,意味着公司实现了帕金森管线的中美两地IND“双报双批”。对此,睿健医药CMO蔡萌博士表示,在获得了FDA特别豁免权之后,NouvNeu001 IND进一步获得FDA批准,展现出了FDA对睿健医药开创性化学诱导平台及其创新产品的高度认可,也为公司后续国际化通路打通了政策壁垒,可将中国本土生产的通用型细胞治疗产品直接出口进行临床实验。公开信息显示,睿健医药是全球较早将“AI+化学诱导”应用于细胞特定功能改造的Biotech。该平台对于细胞功能改造而言,具有更为高效、安全、低成本且更适合大规模工业生产的优势。基于这一独特平台,睿健医药建立了丰富的通用型iPSC(诱导多能干细胞)产品管线,为以帕金森病为代表的神经退行性疾病、失明等“无法治愈”疾病开发通用型细胞治疗产品,带来治愈可能。帕金森是一种常见的神经系统退行性疾病,以静止性震颤、肌肉强直、运动迟缓和姿势平衡障碍为主要临床特征由于尚未存在完全治愈的疗法,被称为慢性“绝症”。据统计,2023年全球帕金森病药物市场规模达382亿元,预计2030年将达到612亿元。但在前沿技术的加持下,睿健医药正为这一疾病带来可逆转病程的全新可能。2024年初,NouvNeu001在北京医院和武汉大学中南医院顺利启动临床试验。目前该临床项目进入加速期,从多中心独立完成的多例临床结果来看,使用NouvNeu001治疗后,不仅实现了MDS-UPDRS评分的快速显著改善,患者的生活质量得到了极大改善;且安全性良好,无相关不良反应。NouvNeu001项目即将进入剂量拓展阶段。神经退行性疾病之外,睿健医药还在其他“无法治愈”疾病领域持续探索。今年3月,公司突破性眼科产品NouvSight001就被美国FDA授予孤儿药认定。
据睿健医药CEO魏君博士介绍,在iPSC这一创新疗法领域,睿健医药保持了高度的严谨性,同时兼顾研发进度。此前公司制定的项目推进计划,都在时间上精确到了“周”,这也为公司连续推动核心管线如期进入临床打下了必不可少的基础。睿健医药成立于2017年,位于武汉光谷生物医药产业基地,全球较早将“AI+化学诱导”应用于细胞特定功能改造的Biotech公司之一,并以此为基础建立了丰富的通用型iPSC产品管线,公司曾在不到半年时间内接连获得A轮与A+轮两笔超亿元融资,投资方包括达晨财智、久友资本、长江创新投资等。
内容中包含的图片若涉及版权问题,请及时与我们联系删除











评论
沙发等你来抢