DRUGAI
今天为大家介绍的是来自美国Genentech, Inc.公司、DigiM Solution LLC公司以及Merck & Co.公司联合发表的一篇论文。药物剂型对确保活性药物成分(API)有效且安全地递送至患者体内至关重要。然而,传统的制剂开发往往依赖于大量的实验室和动物实验,这既耗时又昂贵。本文提出了一种生成性人工智能方法,该方法通过示例产品的图像生成药物产品的数字化版本。该方法使用一个图像生成器,并以关键质量属性(如颗粒大小和药物装载量)为指导,创建可以在数字环境中分析和优化的逼真数字产品变体。本文通过两个案例研究验证了这一方法的有效性:一个用于确定在口服片剂产品中形成贯通网络所需的材料量,另一个用于优化长效HIV抑制剂植入物的药物分布。研究结果表明,该生成性人工智能方法能够准确预测微晶纤维素(MCC)在4.2%含量时的贯通阈值,并生成具有可控药物装载量和颗粒大小分布的植入物配方。与真实样本的对比表明,生成的结构在颗粒大小分布和释放介质中的传输特性方面具有可比性。

物质的结构是其组成和排列方式。典型药物剂型设计涉及三个方面:Q1(定性,指成分选择,如活性药物成分或辅料)、Q2(定量,指成分用量,如API含量)和Q3(结构,指成分的排列方式,如API颗粒大小和空间分布)。Q1、Q2和Q3的交互影响药物的性能和质量。
药物开发中,通过试验调整配方以达到期望性能往往需要多次迭代,尤其是长效药物释放的情况,迭代过程可能耗时且昂贵。减少实验制造和物理试验可以加速药物开发。通过结构成像和计算机模拟方法,能够快速、准确地评估关键质量属性(CQAs),进一步优化配方。本文提出一种生成性人工智能(AI)方法,通过分析示例图像生成药物结构,支持结构特性分析与优化。该方法结合GAN技术和条件控制模块,可以生成指定属性的三维结构。案例研究表明,该方法能准确预测口服片剂中微晶纤维素(MCC)的贯通阈值(4.2%含量),并设计出优化的HIV抑制剂植入物配方。本文方法结合成像、生成性AI和预测建模,为药物开发提供了一种高效、低成本的工具,既可用于药物制剂优化,也适用于其他结构工程领域。
产品样品的数字化转化:通过成像与图像处理AI
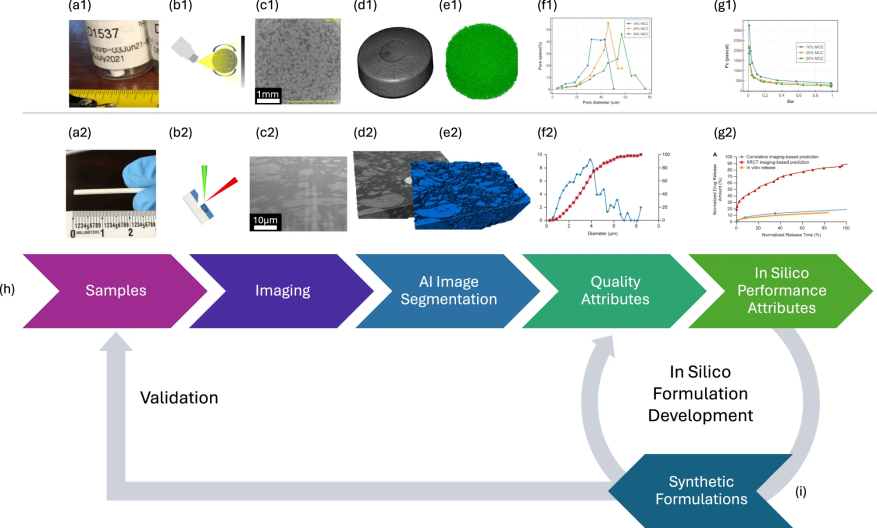
图 1
口服片剂和植入物样品通过通用的工作流程完成数字化处理(见图1)。具体而言,口服片剂按照图1(a1)–1(g1)所示流程进行,而植入物则遵循图1(a2)–1(g2)的工作流程。适用于各种剂型的通用工作流程图则如图1h所示。
口服产品
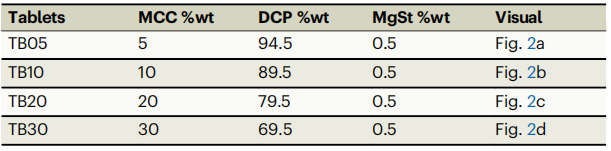
四种口服片剂样品通过X射线显微镜(XRM)成像完成数字化,用于训练和验证结构合成生成性AI。这些片剂主要由两种成分组成:磷酸氢钙二水合物和微晶纤维素。所有片剂都含有0.5%的硬脂酸镁作为内部润滑剂。片剂的配方组成见表1。
表 1
其中,贯通阈值是材料微观结构开发中的重要属性。形成贯通网络所需的材料量取决于主要材料属性(如API颗粒大小和形状)、次要材料属性(如辅料颗粒大小和形状)、配方(如API含量)和工艺(如压实、制粒或热熔挤出)。传统方法通常采用试错方式,耗费大量资源来实现所需的精度。本研究利用结构合成生成性AI确定形成MCC贯通网络所需的含量,这在实验上是极为困难的。
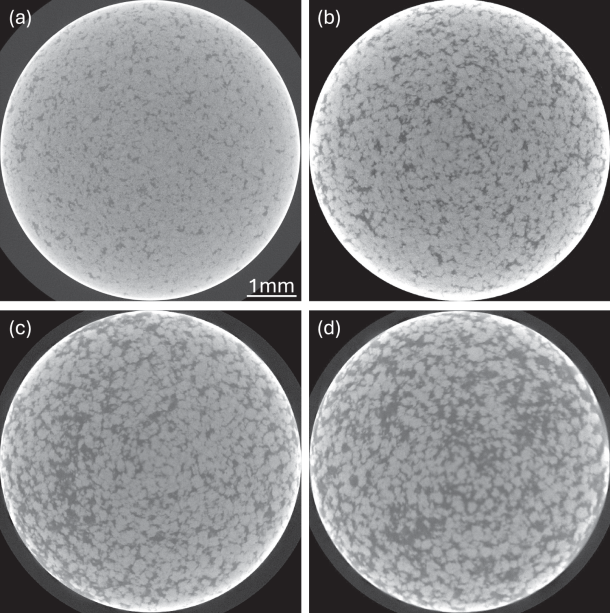
图 2
图2展示了四种口服片剂样品的3D XRM图像体积的横截面,其中MCC含量的增加(表现为深灰色区域)清晰可见。训练和验证使用了样品TB10、TB20和TB30,具体流程见图3。
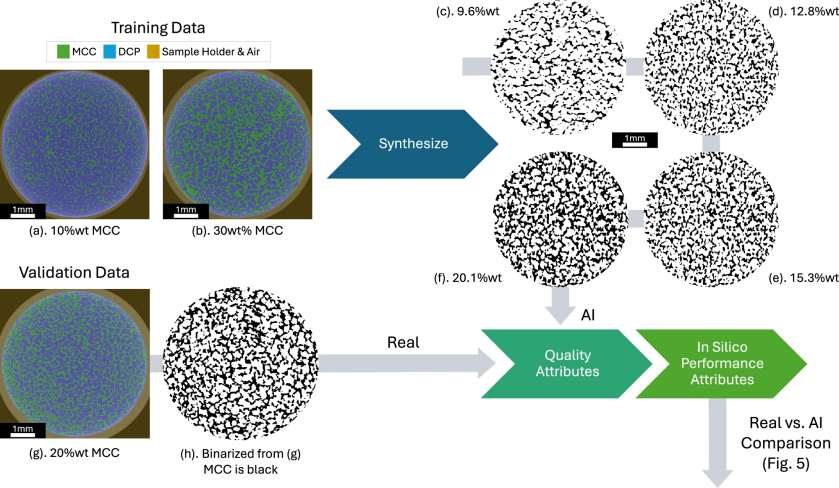
图 3
所有样品的图像均经过相同的AI图像处理流程。TB10和TB30片剂的3D分割图像(图3a, b)被用作结构合成生成性AI的训练数据。训练后,AI生成了包含不同MCC含量的一系列3D图像体积(图3c–f)。每个AI生成的片剂图像体积大小为1000x1000x1000体素,与TB10和TB30的XRM成像数据相似。其中一个含20.1%含量MCC的样品(图3f)被选定为“AI”片剂用于验证。
独立于此,TB20样品经过分割(图3g)并二值化(图3h),被指定为“真实”片剂进行验证,因为该数据未用于AI训练。AI片剂(图3f)和真实片剂(图3h)的MCC相位分别经过三项质量属性表征:颗粒大小分布(PSD)、in silico MICP模拟和in silico 渗透性模拟。
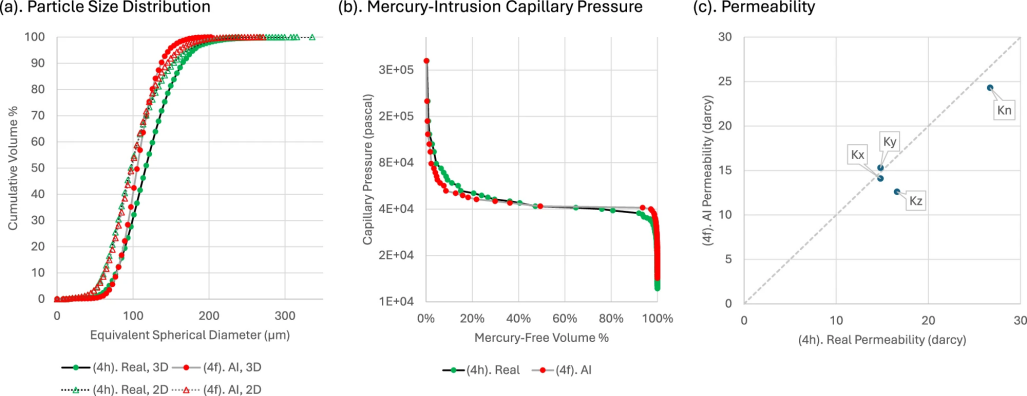
图 4
对比结果如图4所示。图4a比较了XRM图像中的真实20%含量样品和AI生成样品的MCC颗粒PSD计算。每个合成片剂的PSD计算采用两种方法:2D切片法(将3D图像体积视为2D图像堆栈,逐层计算后汇总)和3D体积法(直接对3D图像体积进行计算)。2D切片法的D10、D50和D90数值在真实和AI图像体积之间几乎一致,仅在较大颗粒范围(D90)中,AI(2D)PSD略小于真实值约5%。3D体积法的结果与2D趋势一致,AI(3D)PSD总体上与真实(3D)PSD相当,但在较大颗粒范围差异更明显,D10无差异,D50减少约5%,D90减少约20%。这是由于颗粒聚集导致D90固有的高变异性所致。
在图4b中,通过数值模拟,模拟的汞液被逐步注入MCC网络(X方向),并逐步增加毛细压力(Y+方向)。模拟假设MCC网络内部不含其他材料,因此毛细压力响应仅取决于网络的拓扑结构、连通性和曲折度。真实片剂与AI片剂的两条Pc曲线几乎重合,仅在汞侵入的起始和末端存在差异。初始时,真实片剂的侵入压力略低,表明片剂表面附近的MCC网络喉道略大;末端时,真实片剂的网络喉道较小,因此需要更高的侵入压力。
图4c展示了通过计算流体动力学模拟,基于MCC网络计算的真实片剂和AI片剂的渗透率。假设流动阻力仅由MCC网络的拓扑结构、连通性和曲折度决定(与MICP模拟假设类似)。计算得到了三个方向上的渗透率标量(kx、ky、kz),并进一步转换为标量渗透率值kn。真实片剂与AI片剂的四个标量渗透率值具有可比性,AI片剂的渗透率略低于真实片剂。
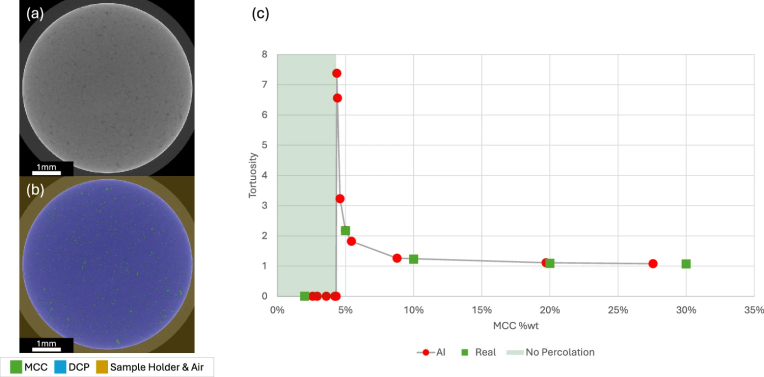
图 5
图5c显示,结构合成AI预测MCC的贯通阈值为4.2%含量(wt)。也就是说,AI预测当MCC含量低于4.2% wt时,无法形成贯通网络;当高于4.2% wt时,贯通网络建立,但曲折度较高,且随着MCC含量增加,曲折度呈指数下降。四种真实片剂的曲折度以橙色方块标记用于进一步验证。作者随后在AI训练后制备了一种含2% wt MCC的片剂(图5a)。其分割图像(图5b)经过与5% wt、10% wt、20% wt和30% wt片剂相同的分割模块处理后,未检测到曲折度;而5% wt(>4.2% wt)片剂检测到了曲折度。这验证了生成性AI预测的贯通阈值(4.2% wt)的准确性。
植入物产品研究
在针对HIV预防性治疗(PrEP)的长效配方中,晶体药物Islatravir(一种核苷逆转录酶转位抑制剂, NRTTI)通过热熔挤出(HME)工艺分散于乙烯-醋酸乙烯酯(EVA)聚合物基质中形成植入物。研究发现,植入物中API(活性药物成分)的分布异质性受API的合成化学、颗粒大小减小方法以及挤出工艺参数的显著影响。为评估这种异质性对药物释放的影响以及优化颗粒工程决策,研究应用了结构合成生成性AI。

图 6
图6 展示了通过AI生成的9种植入物样本,排列为3×3矩阵:
行方向表示药物负载量的径向分布变化;列方向表示颗粒大小的径向分布变化。
中心样本图6e(API颗粒为白色)为均匀分布的植入物。
示例变化:图6a的外层药物负载量和颗粒较大,图6i的外层药物负载量和颗粒较小。
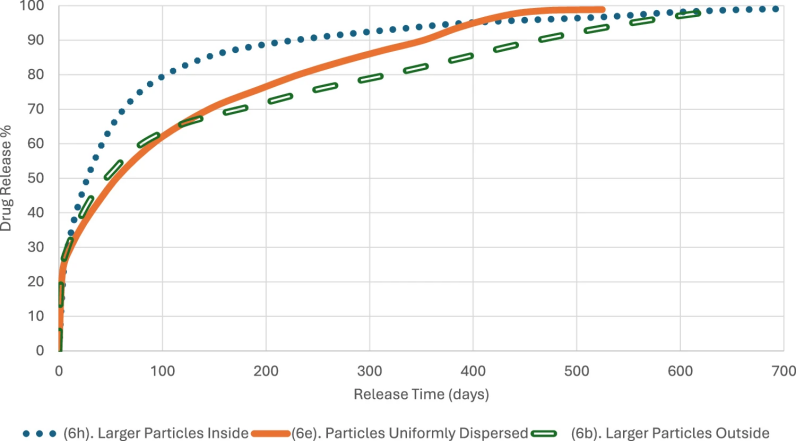
图 7
作者结合验证过的in silico释放预测方法(图7),评估了这9种植入物在24个月设计释放期内的表现:
图6b:外层颗粒较大,释放初期较慢,形成的贯通网络效率较低。
图6h:外层颗粒较小,初期释放速度较快。
图6e:均匀分布样本的释放初期与图6h类似,后期释放则接近图6b。
这项研究说明药物负载量和颗粒大小分布显著影响植入物的释放性能,为优化长效植入物的配方和工艺提供了重要参考。
讨论
本文提出的生成性AI工具具备显著优势,包括快速生成大视野3D图像、减少传统成像的分辨率限制和伪影问题,以及通过条件控制实现药物微观结构的优化设计。这一方法已成功应用于MCC贯通阈值的预测和长效植入物的径向异质性研究。在药物开发中,该工具可优化药物负载量、颗粒分布及释药性能,解决工艺引入的结构异质性问题(如热熔挤出或片剂压实造成的分布差异)。此外,它在FDA Q3一致性评估中提供了新的解决方案,推动剂型设计、工艺开发和微观结构性能优化。尽管目前验证和推广仍需更多努力,但这一工具展示了加速药物研发、降低成本和实现创新的巨大潜力。
编译|于洲
审稿|王梓旭
参考资料
Hornick T, Mao C, Koynov A, et al. In silico formulation optimization and particle engineering of pharmaceutical products using a generative artificial intelligence structure synthesis method[J]. Nature Communications, 2024, 15(1): 9622.
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢