DRUGAI
今天为大家介绍的是来自澳门大学欧阳德方与复旦大学林金钟团队联合发表的一篇论文。脂质纳米颗粒(LNPs)是一种高效的mRNA递送工具,在新冠疫苗中的成功应用就是最好的证明。其中,电离型脂质是LNPs的关键成分,但传统上只能通过耗时耗力的实验室筛选来优化。本研究创新性地运用人工智能(AI)和虚拟筛选技术,通过预测表观电离常数(pKa值)和mRNA递送效率这两个关键特性,来指导电离型脂质的科学设计。研究团队通过两轮AI辅助的分子设计和筛选,从近2000万个候选分子中,先后发现了3个和6个具有潜力的新型脂质分子。在小鼠实验中,第一轮筛选出的一种含苯环结构的脂质,其性能就已经能够与标准对照物DLin-MC3-DMA(MC3)相媲美。更令人振奋的是,第二轮筛选的全部6种脂质都展现出不亚于MC3的性能,其中一种更是达到了高性能对照物SM-102的水平。此外,该AI模型还能清晰地解释分子结构与其生物活性之间的关系,为后续的脂质优化提供了重要指导。

mRNA新冠疫苗的成功让脂质纳米颗粒(LNPs)技术一举成名,确立了其作为mRNA递送“金标准”的地位。这项技术不仅在新冠疫苗中发挥关键作用,还在多种传染病、癌症和遗传疾病的mRNA疗法研发中展现出广阔前景。20世纪90年代末科学家们发现,在脂质体中添加带正电荷的脂质,可以显著提高核酸的递送效率。一个典型的LNPs配方包含四种脂质:电离型脂质、辅助脂质、胆固醇和聚乙二醇(PEG)脂质。其中,电离型脂质堪称LNPs的“灵魂”。这种脂质的特别之处在于其头部含有氨基结构,可以根据环境酸碱度改变其电荷状态(在LNPs中的酸碱平衡点约为6.5)。这种特性让它能在酸性的细胞内环境中带正电荷,既可以牢牢包裹带负电荷的mRNA,又能与细胞内小泡(内涵体)的膜相互作用,帮助mRNA顺利进入细胞质。更巧妙的是,当LNPs在血液中循环时,电离型脂质会失去电荷,这样反而有助于延长其在体内的停留时间。此外,电离型脂质的分子结构还会影响mRNA在体内的表达水平和分布特征。
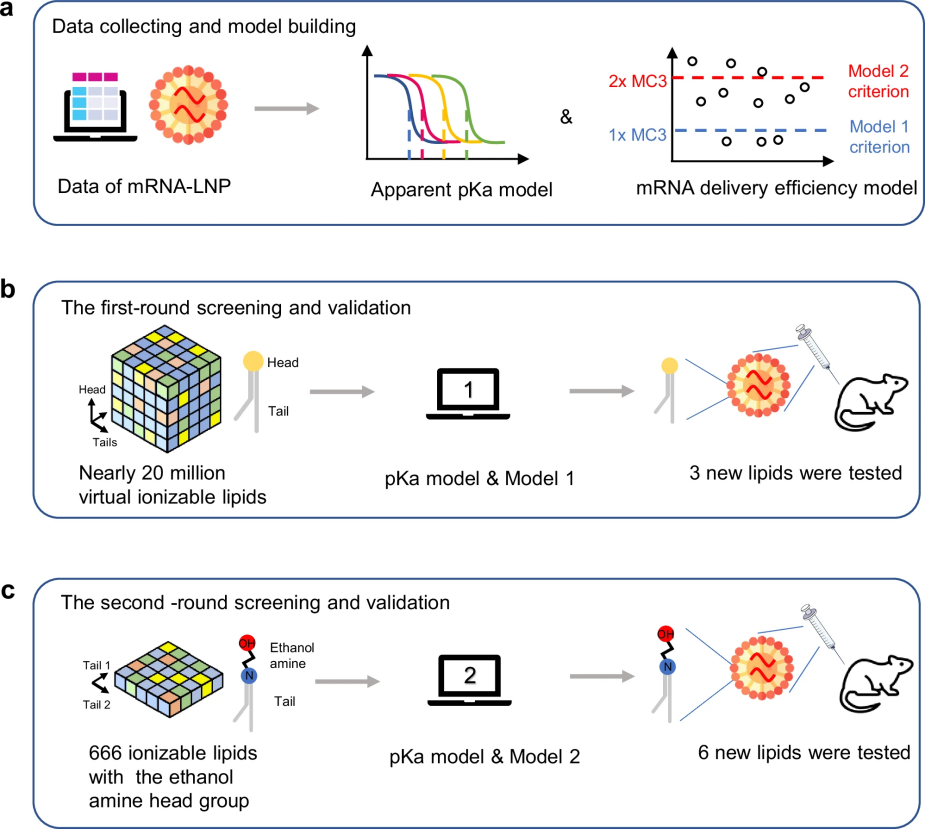
图 1
传统上,科学家们主要通过实验室反复筛选来优化电离型脂质结构,这种方法不仅耗时费力,还需要大量材料和先进设备,效率十分低下。为了解决这个难题,研究团队收集整理了大量文献数据,开发出能够预测LNPs性能的AI模型。如图1所示,这个AI模型可以预测新型电离型脂质的关键特性,大大加快了筛选速度,最终成功发现了多个性能优异的新型电离型脂质。
第一轮脂质虚拟筛选
研究团队开展了一项创新性工作:利用人工智能来预先筛选有潜力的电离型脂质,避免了传统实验方法耗时耗力的问题。这项研究分两个阶段进行,最终成功合成并评估了两批新型脂质分子。
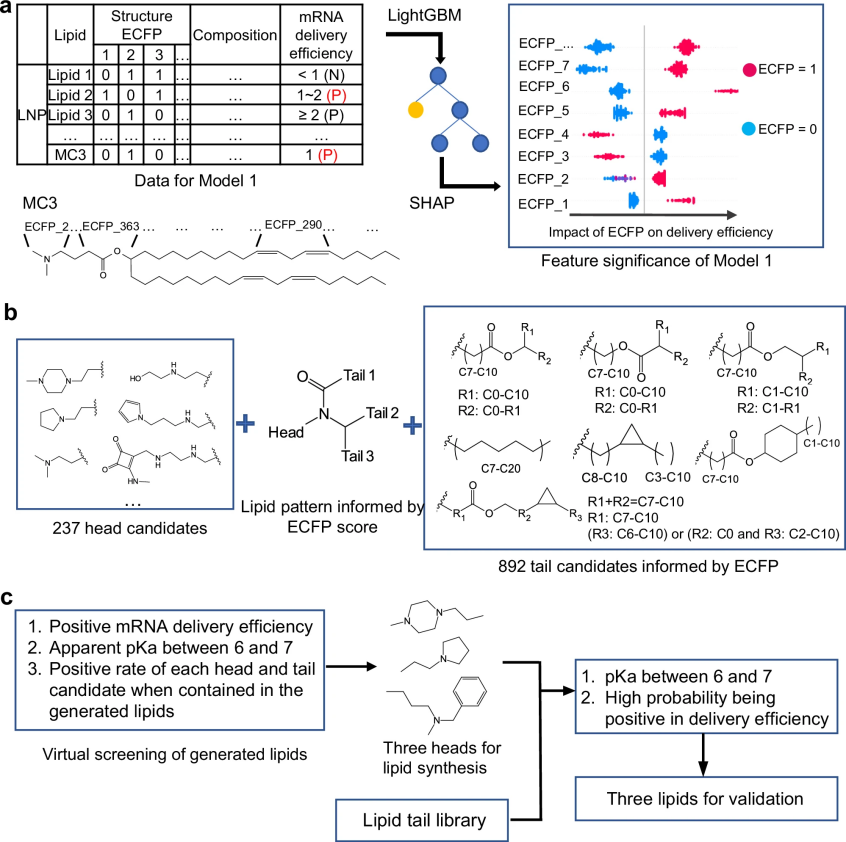
图 2
如图2所示,在第一轮筛选中,研究团队开发了两个智能预测工具:一个用来预测脂质递送 mRNA 的能力,另一个用来预测脂质纳米颗粒的酸碱平衡特性(表观pKa值)。在对比了随机森林和LightGBM两种人工智能算法后,研究团队发现LightGBM在各项评估指标上都表现更好:它不仅能更准确地找出高性能的脂质(召回率高),还能有效地避免误判(准确率高)。实验结果显示,在预测14个新的脂质的递送效率时,模型的准确率达到了78%。在预测9个新的脂质纳米颗粒的酸碱平衡特性时,有7个预测结果与实验数据高度吻合。
随后,研究团队开创性地将人工智能引入电离型脂质的设计过程。如图2b所示,他们首先让AI系统学习分析分子结构的“指纹特征”(ECFP),然后用一种叫做SHAP的智能算法来找出哪些结构特征与递送效率密切相关。分析发现,性能最好的脂质分子往往具有独特的环状结构(像圆环一样的化学结构)在尾部,并采用一种特殊的化学键(酰胺键)将一个“头部”和三个“尾部”连接在一起。基于这些发现,研究团队设计了892种不同的“尾部”结构和237种“头部”结构。如图2c所示,通过不同组合方式,他们在计算机中创造了近2000万个虚拟脂质分子,并对每个分子的酸碱平衡特性(pKa值)和mRNA递送效率进行预测。
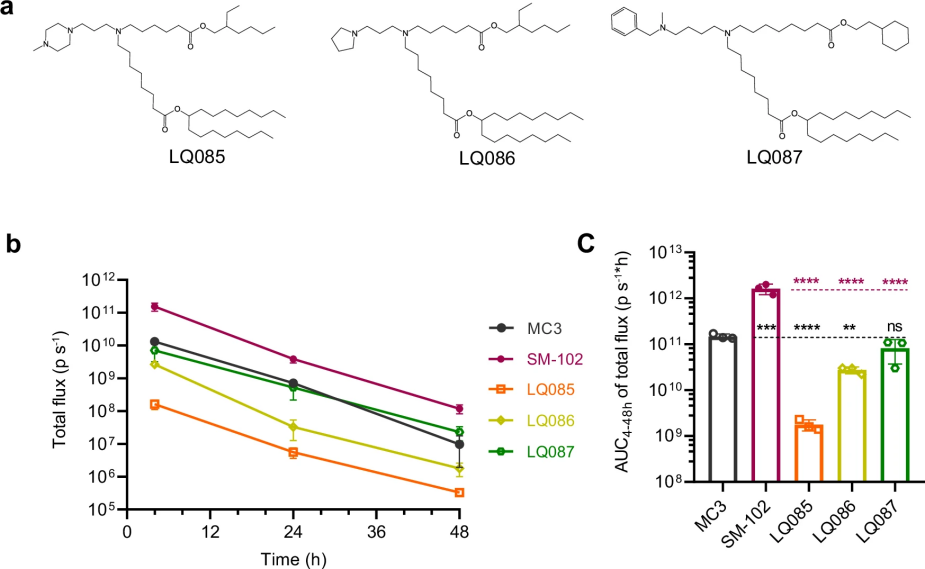
图 3
这种虚拟筛选方法将传统实验室需要数年才能完成的工作缩短到了几周。最终,研究团队筛选出三个最有潜力的候选分子:LQ085、LQ086和LQ087(图3a)。如图3b和3c所示,他们在小鼠体内进行了验证实验:将这些脂质制成纳米颗粒,装载能够发光的荧光素酶mRNA,注射到小鼠体内后追踪发光信号的强度和持续时间。结果显示,LQ087表现最为出色,它的性能与目前广泛使用的MC3相当,虽然还不及Moderna公司的新冠疫苗使用的SM-102脂质,但这一发现为开发新一代mRNA疫苗递送系统提供了重要参考。
第二轮脂质虚拟筛选
第一轮筛选虽然找到了性能不错的LQ087,但研究团队并不满足。他们注意到一个关键问题:此前选择的头部结构在训练数据中出现较少,这可能影响了AI模型的判断准确性。因此在第二轮筛选中,他们将目光聚焦在数据集中最常见的乙醇胺头基上。
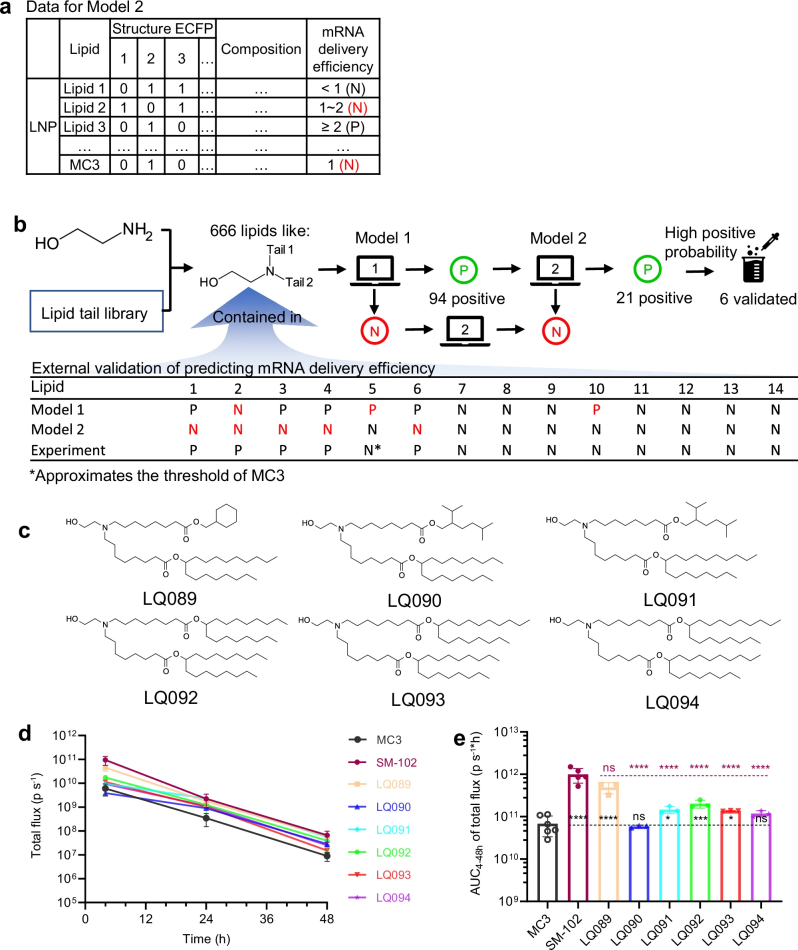
图 4
如图4a所示,研究团队还提高了筛选标准:只有递送效率达到MC3两倍以上的脂质才能被判定为“优秀”。这个新标准(Model 2)虽然导致预测错误增多,但如图4b所示,这些错误都是“宁可错杀一千,不可放过一个”——即可能会错过一些好的候选者,但不会让不合格的分子混入其中。在666个候选分子中,第一阶段的Model 1筛选出94个潜在的优秀分子,而更严格的Model 2进一步将这个数字缩减到21个。如图4c所示,研究团队最终选择了其中6个结构各异的分子(LQ089-094)进行实验验证。
如图4d所示,在小鼠体内的荧光素酶实验中,这6个新型脂质全部展现出优于MC3的性能,其中LQ089的表现尤为出色。在图4e中,通过分析发光信号的强度和持续时间,发现LQ089甚至达到了与Moderna公司的SM-102相当的水平。这一突破性发现表明,AI辅助设计不仅能加速新型递送系统的开发,还有望帮助设计出性能更优的下一代mRNA疫苗载体。
含羟基脂类的构效关系
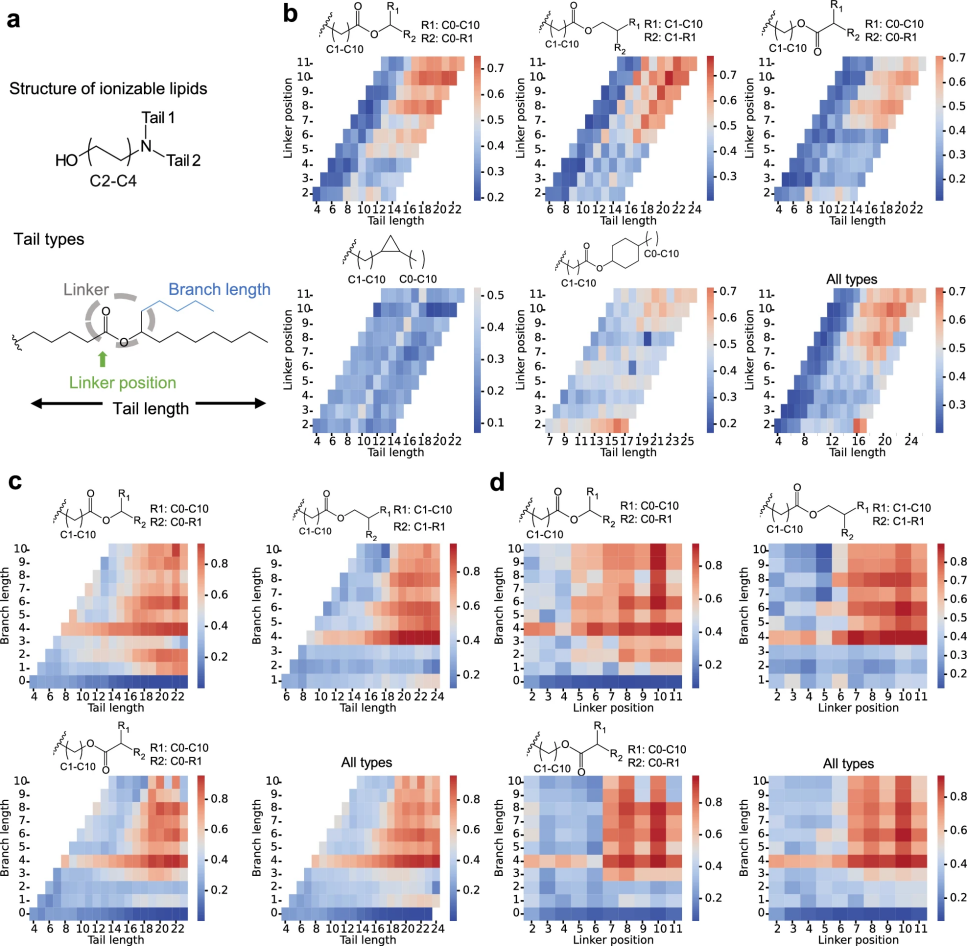
图 5
研究团队利用AI模型揭示了一个有趣的发现:分子结构如何影响脂质的性能。如图5a所示,他们重点研究了一类特殊的电离型脂质,这种脂质的“头部”含有羟基(一种含氧基团),并通过氮原子与两条“尾部”相连。分子的“尾部”结构对其性能影响很大(图5b),带有酯键(一种常见的化学连接方式)的尾部,比带有环状结构(环丙基)的尾部表现更好,成功率超过50%。就像建造摩天大楼需要合适的高度和结构一样,这些分子也有其最佳“尺寸”:尾部长度要超过10个碳原子,连接处要位于第5或第6个位置附近才最合适。不过,也不是越长越好,当尾部总长超过20或连接位置超过10时,反而会影响性能。
有趣的是,如图5c和5d所示,对于那些用酯键连接的尾部,还可以长出“分支”。当分支长度超过3个碳原子时,分子的性能往往会更好。这就像给摩天大楼增加侧翼建筑,只要主楼结构稳固,适当增加侧翼的长度反而能提升整体性能。这些发现为设计新型mRNA递送系统提供了重要指导。通过遵循这些“设计规则”,科学家们可以更有针对性地开发新型脂质分子,提高药物开发的效率。
对新生成的脂质的综合体内研究
为了确保新型脂质能真正应用于疫苗开发,研究团队对它们进行了全方位的实验。
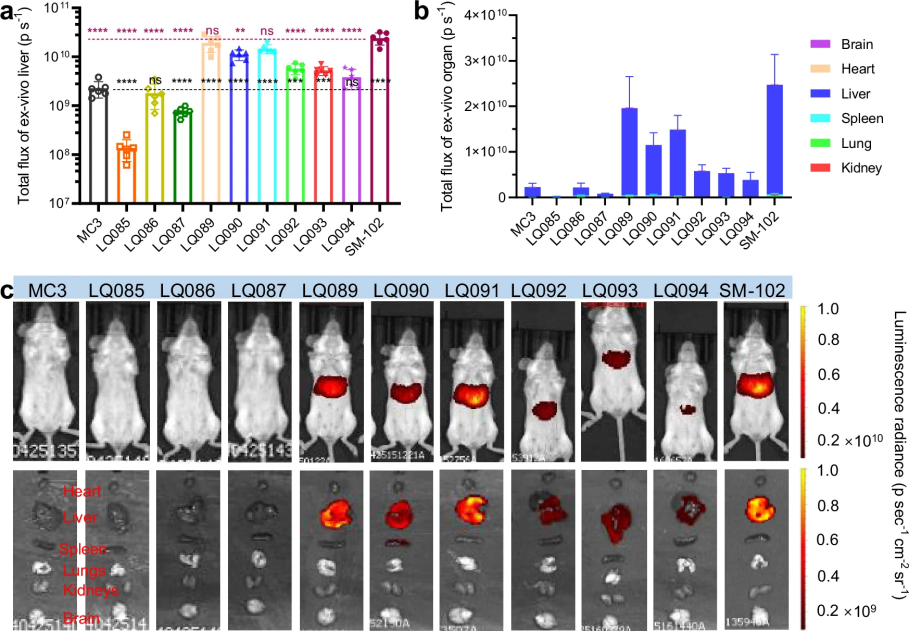
图 6
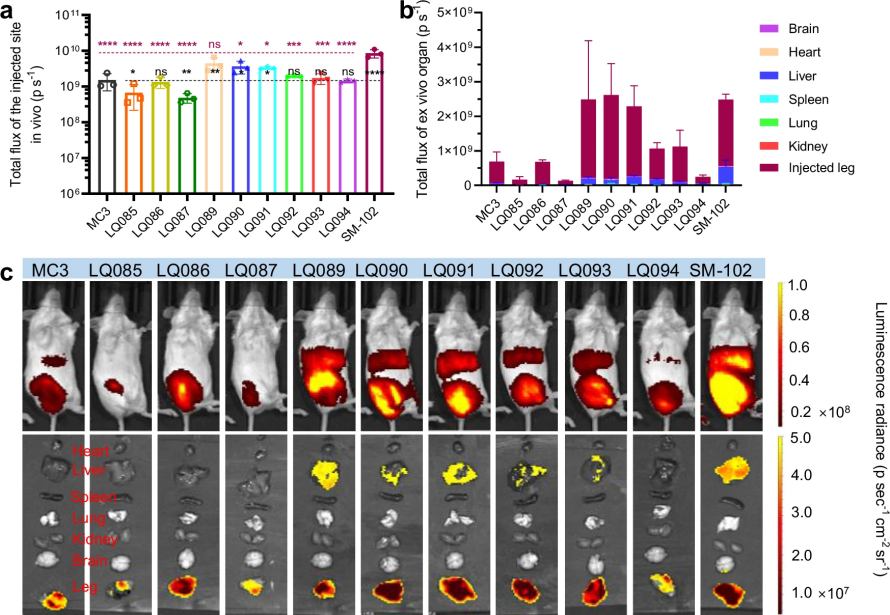
图 7
首先是递送能力测试。如图6和图7所示,研究人员通过两种注射方式(静脉注射和肌肉注射)将装载荧光素酶mRNA的脂质纳米颗粒注入小鼠体内,每只小鼠注射5微克mRNA。通过追踪发光信号,他们发现这些纳米颗粒主要集中在肝脏,这与目前使用的MC3和SM-102的分布特征一致。其中,LQ089和LQ091的表现最为出色,达到了与SM-102相当的水平。
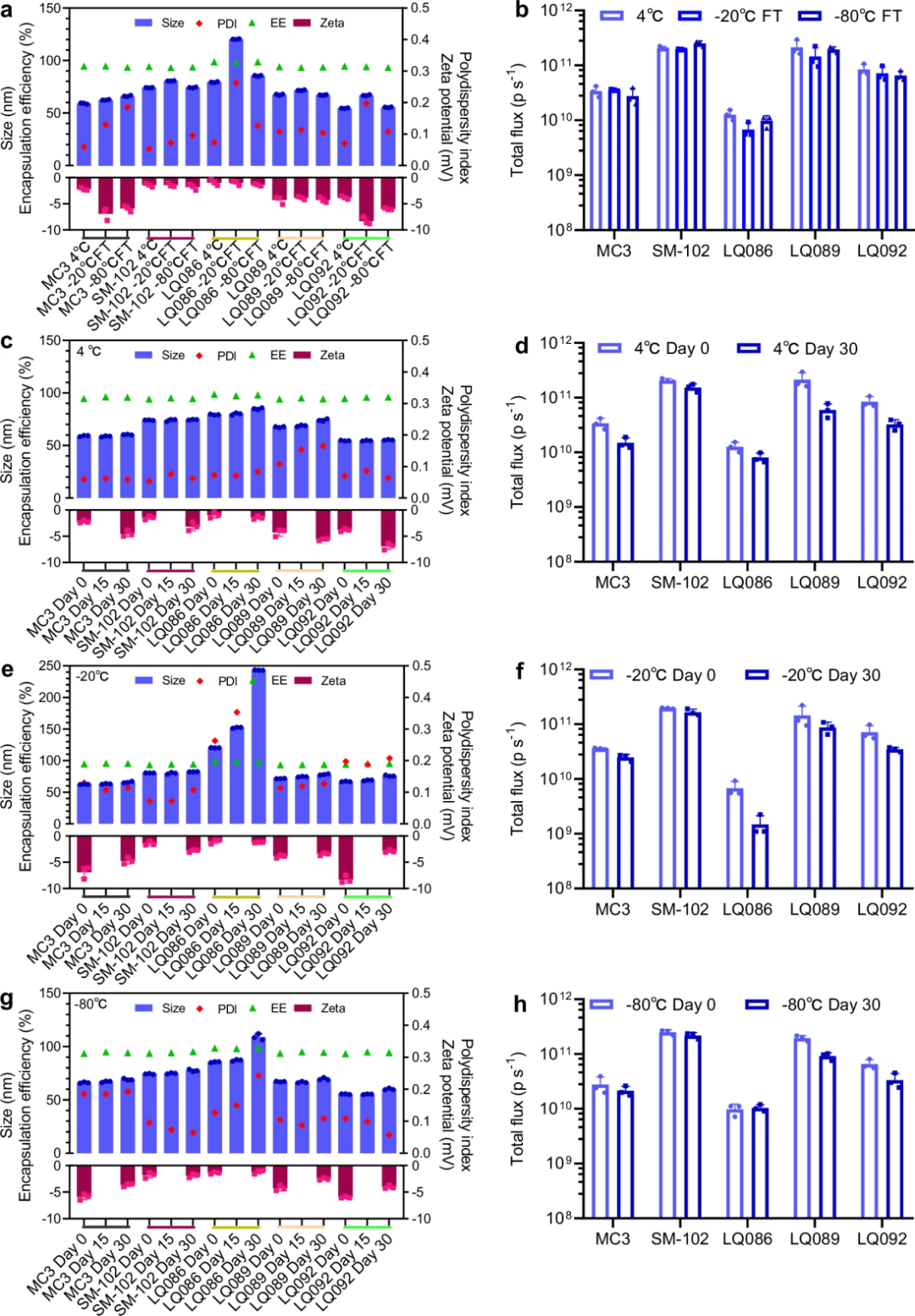
图 8
接着是稳定性考验。如图8所示,研究人员选择了LQ086、LQ089和LQ092作为代表,研究它们在不同储存条件下的表现。结果显示,除了LQ086在-20℃储存时颗粒大小会发生变化外,LQ089和LQ092表现出与MC3和SM-102相当的稳定性。更令人惊喜的是,这些新型脂质在4℃储存一个月后仍保持良好的性能,这对于未来的实际应用非常重要。
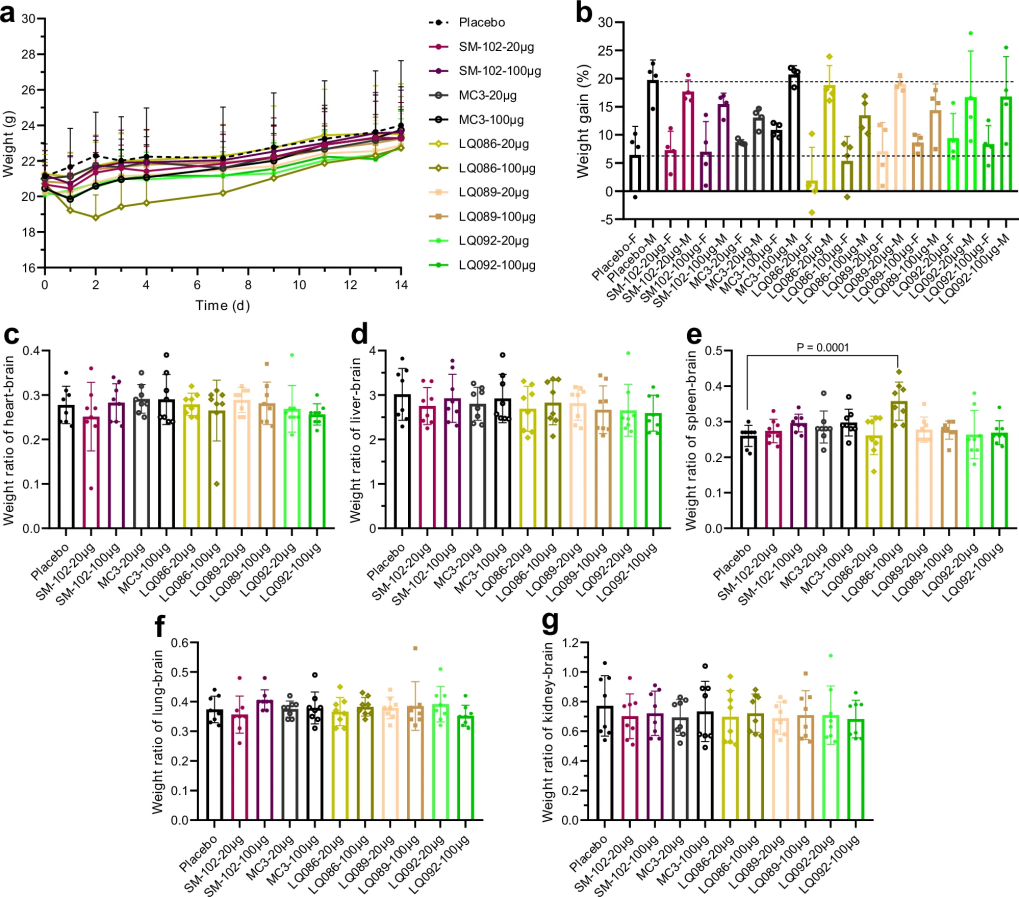
图 9
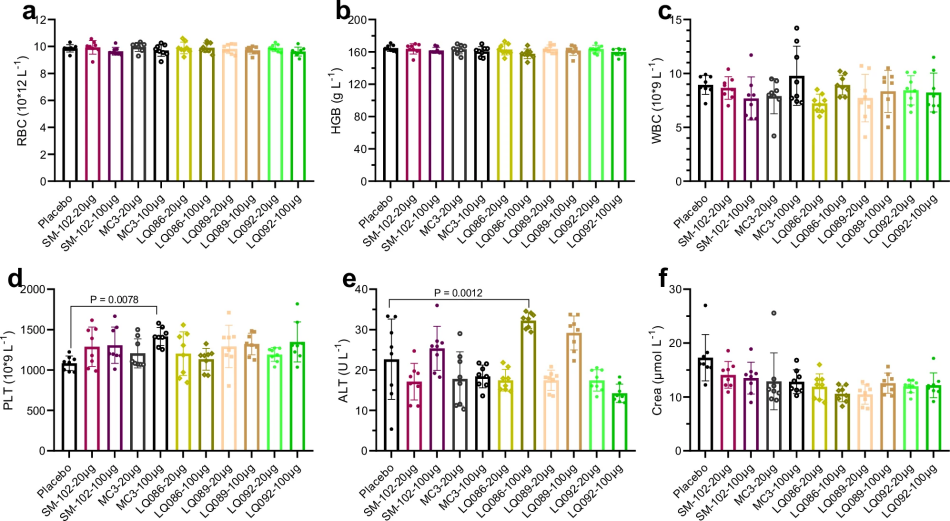
图 10
最后是安全性评估。如图9和图10所示,研究人员进行了高剂量急性毒性实验,将剂量提高到每只小鼠20和100微克(相当于每公斤体重1和5毫克)。通过连续两周监测小鼠的体重变化、器官重量和血液指标,发现除了LQ086在高剂量时可能会引起一些免疫反应外,其他新型脂质都表现出优越的安全性。即使在肝功能指标略有升高的情况下,仍在可接受范围内。这些全面的评估结果证实,通过AI辅助设计开发的新型脂质不仅性能优异,还具有良好的稳定性和安全性,为开发更高效的mRNA疫苗递送系统提供了新的选择。
讨论
这篇研究讨论了如何利用人工智能加速开发mRNA递送系统中的关键成分——电离型脂质。文章强调了酸碱平衡特性(pKa值)的重要性:当pKa值在6.0-7.0之间时,脂质纳米颗粒才能有效递送mRNA。研究团队采用LightGBM算法开发了两个AI模型,一个用于预测递送效率,另一个用于预测pKa值。在第二轮筛选中,研究团队巧妙地结合了两个不同精度的模型,成功发现了六种性能优异的新型脂质。研究还发现AI模型能够解释分子结构与性能之间的关系,这为未来开发更高效的mRNA递送系统提供了重要指导。
编译|于洲
审稿|王梓旭
参考资料
Wang W, Chen K, Jiang T, et al. Artificial intelligence-driven rational design of ionizable lipids for mRNA delivery[J]. Nature Communications, 2024, 15(1): 10804.
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢