
点击蓝字 关注我们

微末生物
Nanomega CryoAI
人体内有一种病毒,能悄无声息地潜伏在我们的细胞中,终身潜伏感染,等待时机爆发周期性再激活,全球血清患病率接近83%。这种病毒就是人巨细胞病毒Human cytomegalovirus(HCMV),它属于β疱疹病毒家族,广泛存在于人群中,对健康人群通常没有危害,但对免疫缺陷人群和新生儿来说,却构成了严重的威胁——HCMV是世界范围内导致出生缺陷的主要病毒,每200名新生儿中就有1人感染HCMV,并经常导致失明、小头畸形和耳聋等神经系统残疾,因此,防治HCMV重要且紧迫。抗HCMV的药物的肾毒性和耐药毒株的出现,使减毒活病毒的疫苗开发成为炙手可热的话题。
先前的HCMV减毒活疫苗候选疫苗来自实验室菌株,与WT相比缺乏多个基因,目前在预防感染方面的效果有限。2024年5月,来自加州大学洛杉矶分校(UCLA)的周正洪教授作为通讯作者发表文章Structure-guided mutagenesis targeting interactions between pp150 tegument protein and small capsid protein identify five lethal and two live-attenuated HCMV mutants,研究利用结构对pp150- SCP相互作用所必需的几个保守结构域进行突变分析(结构导向的诱变技术),确定了一个显著减弱病毒复制的突变(pp150-K255E),并证实pp150与感染细胞细胞核内的病毒衣壳相关。本研究可能为开发减毒活疫苗提供新的思路,也为理解HCMV病毒的复制机制和开发更多针对HCMV的治疗方法提供了重要的线索。
HCMV病毒衣壳上变化多端的SCP
和α和γ疱疹病毒相似,身为β疱疹病毒家族的HCMV病毒粒子也有四层:大的双链DNA基因组被紧紧包裹在二十面体衣壳中,衣壳被无定形被膜蛋白包裹,并被脂质包膜包裹。病毒衣壳包括955个MCP(major capsid protein)拷贝。Tri(triplex protein complexes)为三联体蛋白复合物,1个Tri包括1个Triplex 1和2个Triplex 2(Tri2A & Tri2B),装饰在MCP外壳的外部,将相邻的MCP连接在一起。
HCMV病毒还有SCP(small capsid protein),如图1所示,这些小衣壳蛋白在每个MCP塔顶端,在疱疹病毒中有最大的结构和序列变异。SCP个头不大,却发挥着重要作用:
搭建桥梁:SCP像是一座桥梁,连接着衣壳上的Tri和MCP,并帮助Tri连接相邻MCP,让衣壳更加坚固。
稳定衣壳:可以增强衣壳的稳定性,让HCMV 在复制过程中更加安全。
调节成熟:HCMV在细胞质中复制时会经历一系列成熟过程,SCP 也参与其中,帮助病毒完成最终的组装。
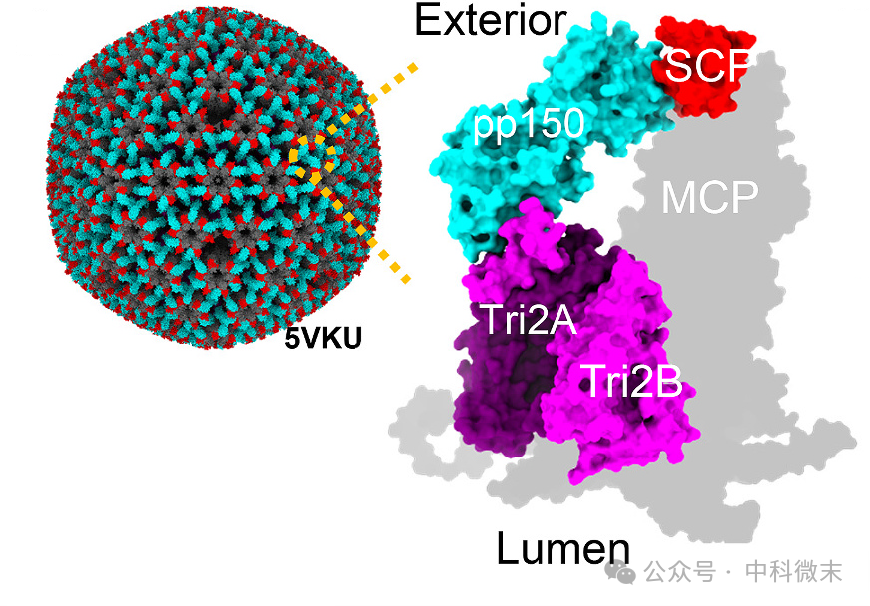
图1 带有pp150外壳的HCMV衣壳的原子模型(左)
右 显示了亚基的放大视图,用不同颜色强调不同的亚基相互作用
HCMV病毒衣壳上的门把手:pp150蛋白
HCMV病毒复制过程中,一个关键的步骤就是衣壳的组装和成熟。衣壳需要在细胞质中经历一系列复杂的变化,才能最终成熟并释放出病毒。在这个过程中,pp150蛋白发挥着至关重要的作用,它像“门把手”一样,连接着衣壳的SCP和Tri,并与其他蛋白相互作用,维持衣壳的稳定性和功能(见图1)。该团队之前的研究观察到SCP介导pp150-衣壳结合,但是SCP和pp150之间的界面尚未被彻底表征,并且仍然不清楚哪些残基或结构域与pp150-衣壳结合有关。
更多关于pp150蛋白介绍可参考微末往期文章 ↓
Science重磅:冷冻电镜揭示世界上最大的疱疹病毒结构全貌(详细解读)
如图2所示,HCMV的原子模型呈现一个相对较小的(~446 Å2)pp150- SCP界面,由互补的疏水或极性氨基酸簇组成。
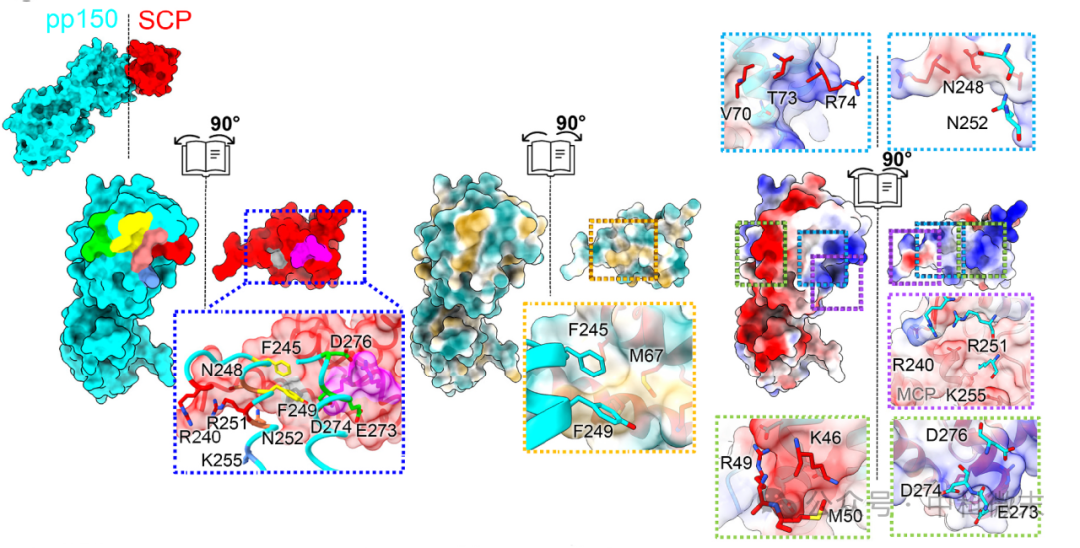
图2 pp150和SCP之间的表面接口,突变用簇着色(左)。
具有亲水性、中性和疏水性区域的表面分别用青、白和黄色表示(中)
正、中性和负静电电位分别用蓝、白和红色表示(右)
SCP-pp150界面上的氨基酸突变
会产生致死型和减毒型表型
根据以上结构,团队引入突变,将每个互补簇替换为非互补簇,并以GFP为信号,转染细胞进行验证。结果显示,pp150- SCP界面外的簇突变对病毒复制没有可观察到的影响,然而如下图的GFP荧光信号所示,在界面的任何极性或疏水性区域(包括pp150的N248和N252附近)的突变对病毒是致命的。
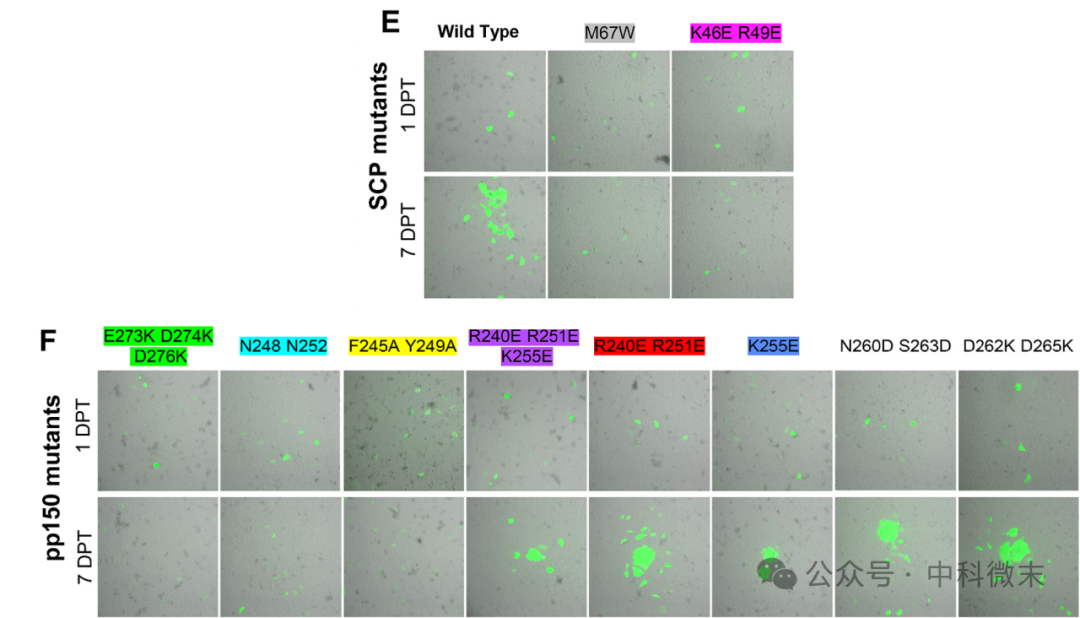
图3 (E)转染后1(上)或7(下)天,转染SCP突变细胞的代表性荧光显微镜图像。(F)转染后1或7天pp150突变细胞的代表性荧光显微镜图像
下表列出了在转染细胞中观察到的簇突变及其对病毒复制的影响。
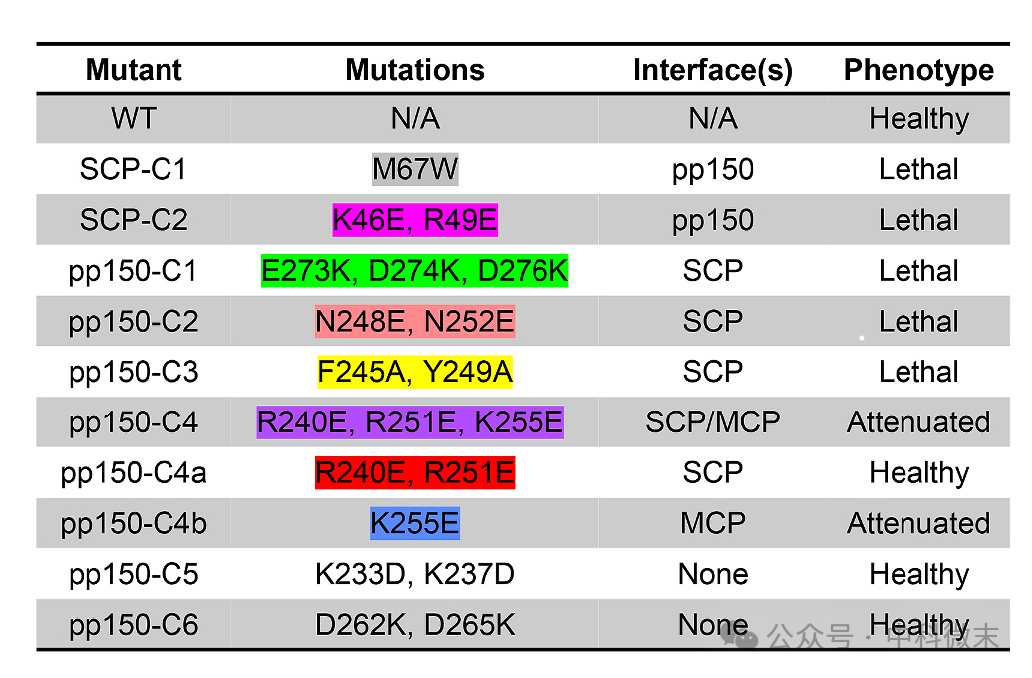
SCP-pp150界面上的氨基酸突变
会破坏pp150-衣壳的相互作用
接下来,团队进一步探究观察到的产生致死型和减毒型的原因是否在于pp150-SCP相互作用的破坏。
为此,团队将pp150-血凝素(HA)和FLAG-SCP标记蛋白克隆到pcDNA3表达载体中,并将WT和突变基因的质粒共转染到ARPE-19细胞中,固定用于免疫荧光测定(IFA)。如图4A显示,IFAs显示WT SCP与WT pp150共定位为转染的ARPE-19细胞的胞浆点(黄色)。相比之下,含有致命SCP或pp150突变体的质粒表现出分散在整个细胞质中的离域信号。pp150-C4突变病毒表现出与WT相似的SCP共定位,表明pp150-C4尽管复制减弱,但仍容易与SCP关联。这一发现与K255E突变通过破坏pp150-MCP界面驱动减毒的观点是一致的。
为了证实IFA的结果,以上质粒被共转染到HEK-293细胞中进行共免疫沉淀试验。如图4B所示,在对照组WT中,免疫印迹很容易检测到FLAG标记的SCP;但致死突变未显示FLAG信号。通过比较,pp150-C4显示出与WT一致的SCP信号,进一步支持了我们的假设,即相互作用没有中断。
总之,这些发现表明,致命的簇突变是那些破坏pp150-SCP界面的突变,即,直接涉及pp150-SCP界面的保守极性或疏水结构域的氨基酸取代对病毒复制有害,这些影响可直接归因于pp150-SCP关联的破坏。而破坏其他界面可以产生减毒的突变。
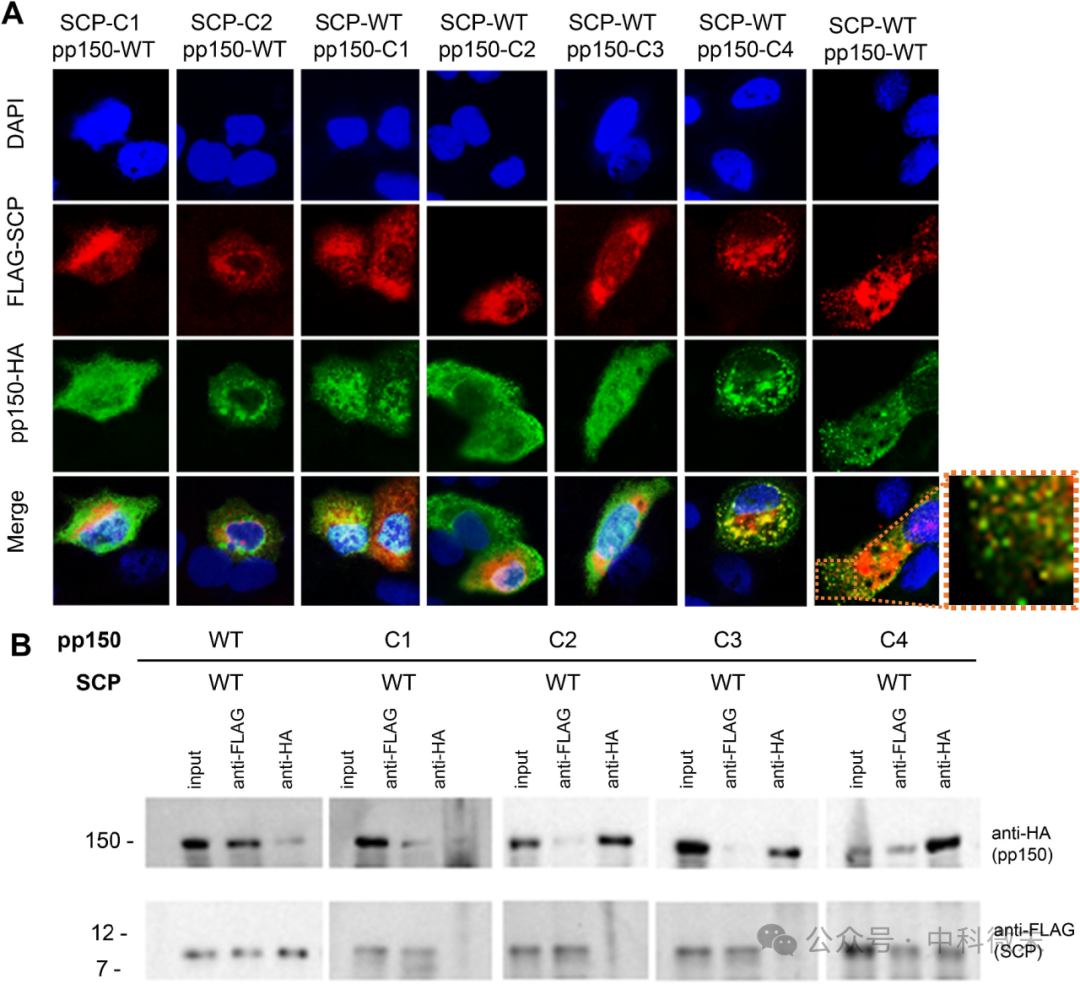
图4 突变体pp150和SCP相互作用的特征
(A) ARPE-19细胞转染WT或pp150或SCP上簇突变后的免疫荧光分析,显示抗HA(绿色)和抗FLAG(红色)共定位,DAPI染色细胞核(蓝色)
(B) 共免疫沉淀(CoIP)实验显示pp150簇突变体与WT SCP的相互作用。蛋白提取物用抗HA或抗FLAG抗体沉淀,SDS-PAGE分离。用抗HA和抗FLAG抗体免疫检测蛋白-蛋白相互作用
pp150减毒突变体
维持基因组包装和病毒成熟
为了表征pp150-C4突变体的pp150-MCP相互作用受损,会对细胞内的病毒组装和复制产生什么影响,团队使用荧光激活细胞分选(FACS)对GFP信号进行门控,富集pp150-C4突变体感染的HCMV细胞。将这些pp150- C4感染的细胞固定,包埋在树脂中,并用于生成超薄切片(~55 nm)用于透射电镜(TEM)分析。这些超薄切片被转移到碳支持膜涂层的TEM网格上并染色。根据电镜观察的外观,鉴定了核膜,并将衣壳群体分为三组,如图5所示,包括(A-,白色箭头)空衣壳,(B-,白色带黑色轮廓箭头)含支架蛋白衣壳和(C-,黑色箭头)基因组填充衣壳。
与A-衣壳相比,WT细胞核中B-和C-衣壳的比例更高,这种分布在pp150-C4感染的细胞中也相似。除了衣壳分布与WT相似外,pp150-C4感染的细胞还具有与vAC相关的病毒产物,包括包膜的C-衣壳,这表明与pp150缺失突变体不同,这些pp150氨基酸突变体病毒成熟效率高。
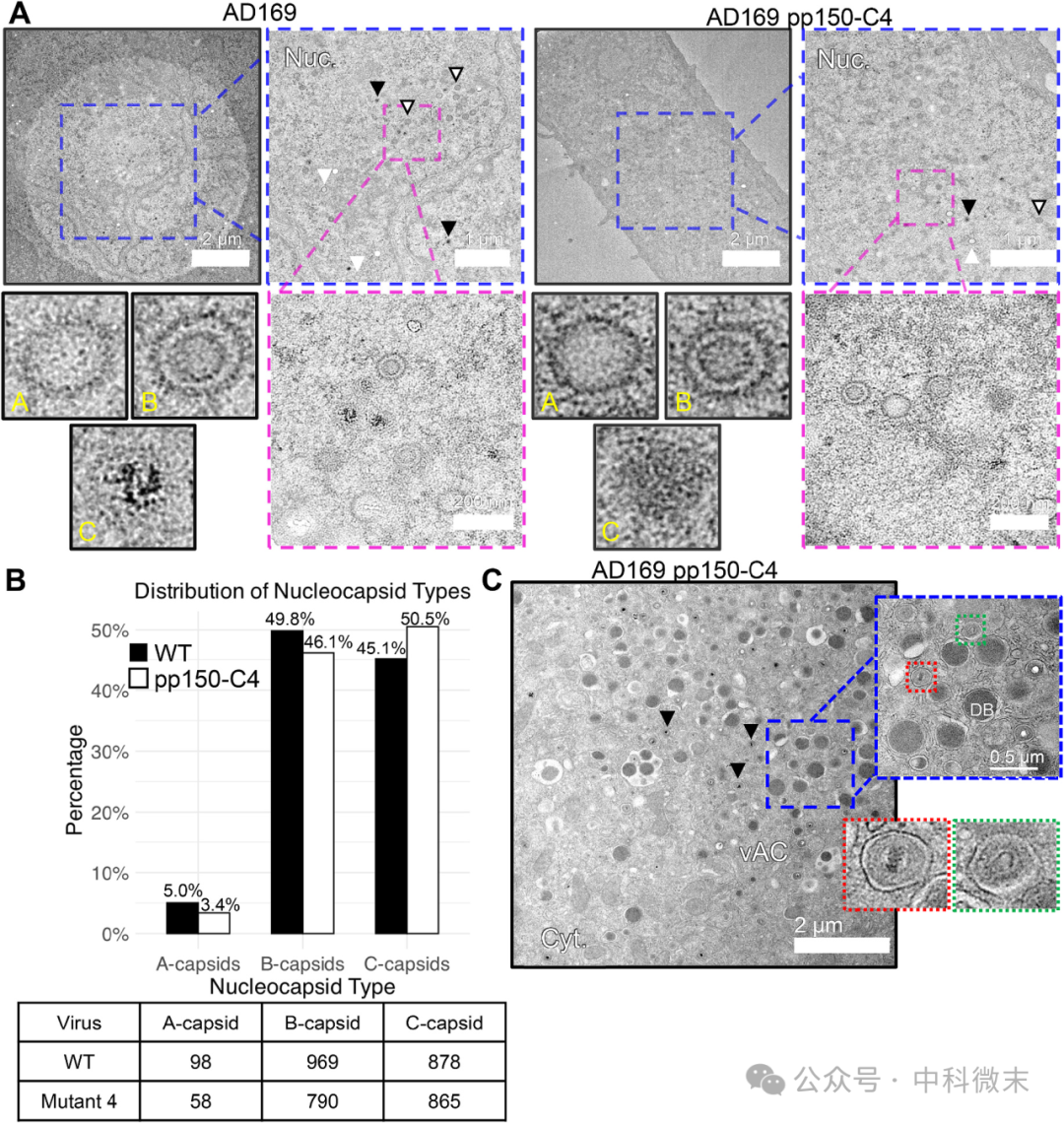
图5 WT和突变型HCMV感染的ARPE-19细胞的TEM切片
(A)WT(左)和AD169 pp150-C4感染细胞的代表性TEM显微照片(右),放大视图突出显示不同的衣壳类型。
(B)A-、B-和C -衣壳的分布占总计数和随附表的总数的百分比
(C)来自AD169 pp150-C4感染细胞的代表性vAC显微照片,放大后的颗粒被包膜(右上)以及致密体(DB)和包膜颗粒的例子(右下)。
先前的研究表明,pp150缺失使HCMV无法在细胞质阶段成熟,很少观察到细胞质衣壳和高度囊化的vAC。相比之下,团队的pp150-C4突变体HCMV尽管对病毒传播有显著的衰减,但似乎能够有效地进行基因组包装、核出口和vAC形成。这似乎表明,此研究结果中pp150-C4产生的完整病毒粒子具有显著降低的传染性,可能为开发减毒活疫苗提供新的平台。
pp150在核膜上移位
与细胞核内的衣壳结合
因为pp150缺乏可识别的核定位信号或标志,所以目前尚不清楚pp150如何转运到细胞核中,以及其是与细胞核还是胞质的衣壳结合的。事实上,先前的研究已经证明了核衣壳在没有pp150的情况下具有核输出能力。在发现pp150-C4-HCMV在vAC形成方面没有明显缺陷后,研究团队试图确定pp150是否被正确地整合到突变病毒的核衣壳中。
由于pp150-C4病毒的复制效率低,因此从培养基中纯化完整病毒体的工作变得复杂,需要改进培养程序来纯化被感染细胞的核衣壳。与图6左侧的WT型HCMV类似,右侧显示的从细胞核中纯化的pp150-C4型HCMV核衣壳主要是A -衣壳或B -衣壳,与先前的发现一致。
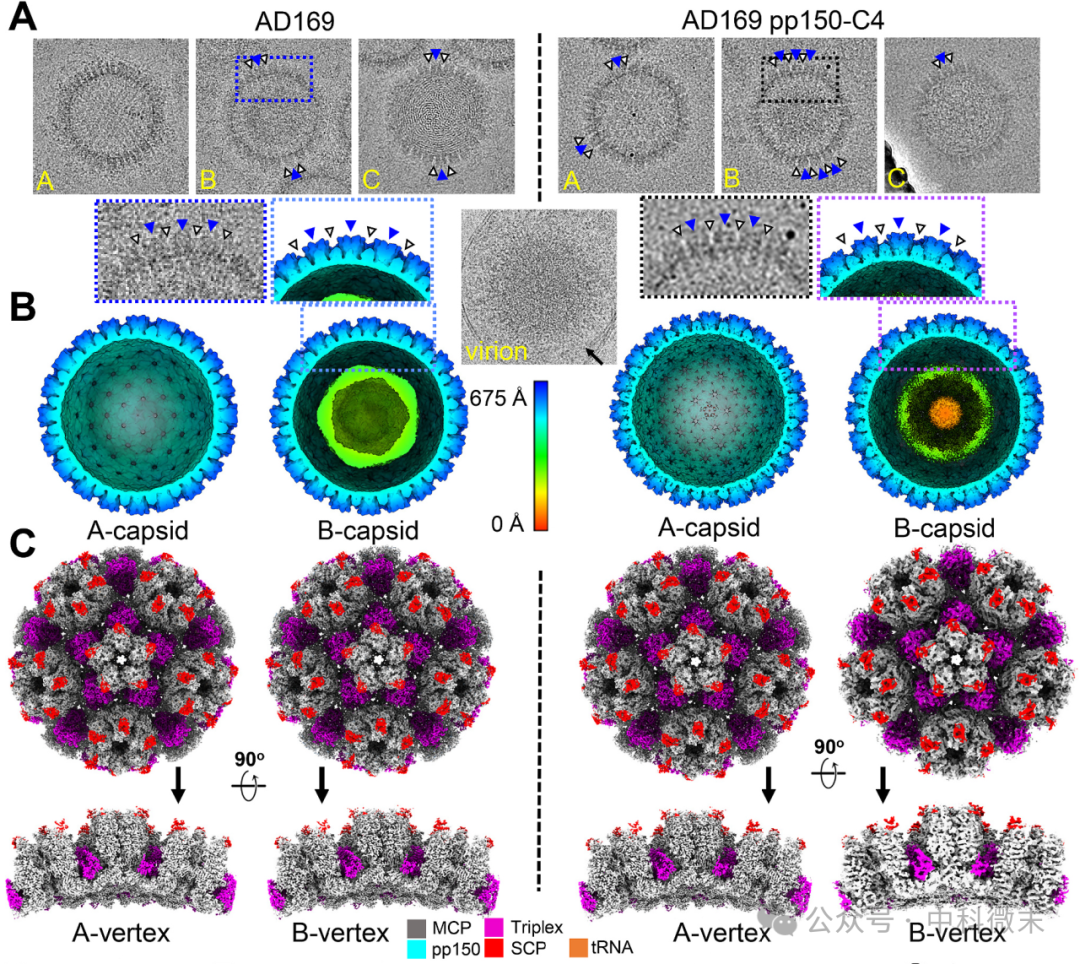
图6 核衣壳的三维重建
(A)从WT AD169(左)和AD169 pp150-C4突变体感染细胞(右)和病毒粒子颗粒(中下)纯化衣壳的代表性冷冻电镜图像。
(B)WT(左)和AD169 pp150-C4 A和B衣壳的三维重建(以与衣壳中心的距离为颜色)与MCP塔(蓝色箭头)和它们之间的空白区域(黑色箭头)
(C) 衣壳顶点亚粒子重构图(B),由衣壳蛋白着色以传递核衣壳组成,从衣壳外部和作为横截面(底部)观察
考虑到pp150和SCP在病毒感染期间在相似的时间点表达,可以想象这些相互作用同样发生在病毒感染的细胞中。由于SCP被认为是通过支架蛋白和MCP一起运送到细胞核的, 团队猜测,pp150与该复合体的细胞质关联将为核运输提供一种合理的机制。
pp150蛋白在核衣壳体中分布
如图6,团队发现了关于pp150蛋白在核衣壳体中分布的有趣现象:
WT和pp150- C4突变体样本的初始冷冻电镜(Cryo-EM)衣壳重建显示,WT病毒粒子中pp150占据的位置没有明显的密度(图6 B和C);含有C-衣壳的一小部分基因组的3D重建也缺乏pp150密度(图6-2);意味着在野生型病毒粒子中,pp150蛋白会覆盖在衣壳蛋白上,形成一层保护层。然而,在pp150-C4突变体核衣壳体中缺失了pp150蛋白。
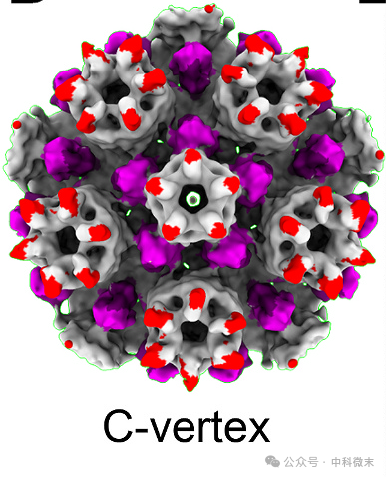
图6-2 WT -C衣壳的低分辨率顶点亚粒子重建显示缺乏pp150密度
虽然这些发现与先前报道的结构一致,但仔细检查核衣壳的冷冻电镜图像发现MCP塔之间明显存在空白;相比之下,在病毒粒子的低温电镜显微照片中,pp150的被膜使我们无法区分MCP塔。进行深入的数据处理和三维重建后,如下图展示其低温电镜密度对应于pp150和tRNA,与先前发表的结构相似,观察到与WT类似的被皮的衣壳图像,表明突变体中pp150-衣壳关联。
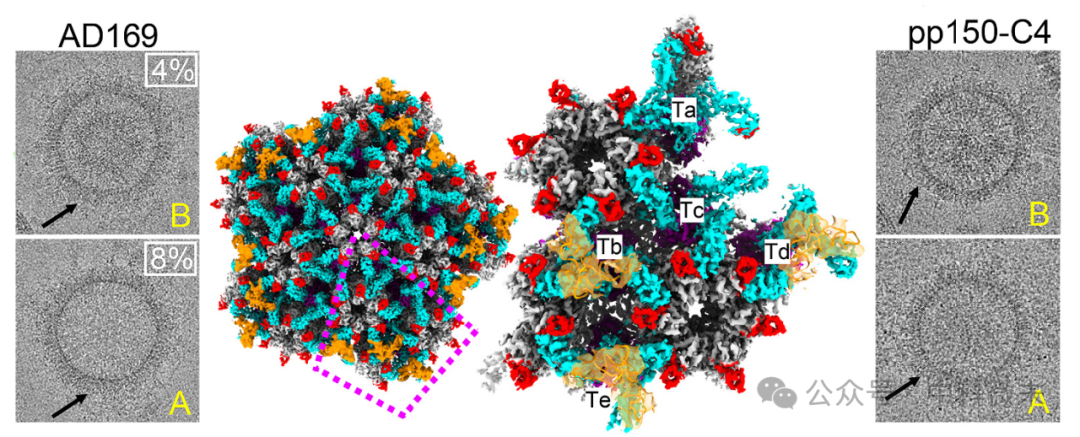
图7 核衣壳的三维重建显示出了其可变性
左:具有代表性的冷冻电镜图像显示B-(上)和A -衣壳(下)周围模糊的被膜(黑色箭头),以及被膜观察到的B-和A -衣壳总数的百分比;
中:中粒子产生的顶点亚粒子,放大图显示pp150密度(青色)和pp150和tRNA分布的不对称单元(中右)的存在。
右:被皮模糊的pp150-C4突变体衣壳代表图像(黑色箭头)
尽管有证据表明pp150在感染细胞的细胞核中形成,但先前对无基因组、细胞核来源的HCMV核衣壳的结构研究表明pp150不存在。团队同样观察到,大多数核衍生衣壳在低温电镜图像和3D重建中缺乏被膜。奇怪的是,低温电镜重建也揭示出,从核中纯化的C-衣壳,通常被认为是pp150关联的最有可能的候选者,也缺乏pp150被膜。
团队对此进行了讨论:通过冷冻电镜图像可以观察到,大约8%和4%的A-和B -衣壳分别具有由pp150和tRNA组成的被膜。由于细胞核衍生的C-衣壳是出了名的不稳定,而且在感染细胞中,A-衣壳只占病毒颗粒的一小部分,团队合理地假设,在纯化的样品中,许多A-衣壳来自基因组较早产生的C-衣壳。因此观察到的更大比例的被膜A-衣壳可能反映了pp150与C-衣壳的优先结合。
总结
在疱疹病毒中,病毒粒子组装是一个由病毒特异性蛋白驱动的严格调控过程,使其成为药物开发的一个有吸引力的靶标。β-疱疹病毒特异性被膜蛋白pp150是细胞质组装的组成部分,需要核衣壳结合才能发挥其功能。
当代HCMV减毒活疫苗候选物依赖于低致病性实验室菌株的功能获得,然而,这些菌株含有基因突变和缺失,可能不可预测地影响诱导免疫反应的保真度。而本文报道的工作代表了首次用结构引导设计和BAC诱变进行致命和减毒HCMV突变,并对其鉴定,并提出了关于pp150-SCP和pp150-MCP相互作用在病毒复制中的作用的重要问题。
本研究结论的优势之处在于:
高度保守的pp150氨基酸突变导致病毒复制显著减弱,而无需删除整个基因
pp150 K255E突变似乎不会阻止pp150-衣壳结合,这意味着这一重要抗原仍然呈递给宿主。因此,理论上,pp150 K255E突变可以引入临床菌株,并有望在对免疫反应影响最小的情况下类似地减弱病毒复制
由于pp150 K255在其他物种的CMV中是保守的,因此这种突变可能更适合在动物模型中进行研究,以确保其安全性
最重要的,与野生型病毒相比,后者产生的病毒传染性要小得多,值得进一步研究作为减毒活疫苗的候选
随着结构生物学和分子生物学技术的不断发展,相信未来会有更多关于pp150蛋白的研究成果出现,为战胜HCMV病毒提供新的武器。鑫研微末团队依托自主研发的冷冻电镜技术,专注提供结构生物学研究服务,实现目标蛋白原子级高分辨率的结构解析。鑫研微末团队在冷冻电镜技术方面积累了大量算法与专利,可提供“高难度结构解析有解决方案,低难度结构解析更迅速、价格更优惠”的技术服务。展望未来,鑫研微末将继续致力于冷冻电镜技术的研发和创新,持续推出更多切合客户需求的结构解析解决方案。
更多关于HCMV往期文章:
Science重磅:冷冻电镜揭示世界上最大的疱疹病毒结构全貌(详细解读)
#出生缺陷 #免疫缺陷 #Cryo-EM #纳米颗粒 #病毒样颗粒(VLPs) #疱疹病毒 #HCMV
加州大学洛杉矶分校Alexander Stevens为本文第一作者。
加州大学洛杉矶分校(UCLA)的周正洪教授为本文通讯作者。
原文链接:
https://pmc.ncbi.nlm.nih.gov/articles/PMC11260070
点击“阅读原文”,查看文章↓
如果您对特定研究领域感兴趣,欢迎通过微信公众号搜索 “Cryo-EM”、“膜蛋白”、“纳米颗粒”等关键词,查阅我们过往发布的相关文章。
您还可以添加我们的研究助理,以便进行更详细和具体的咨询。我们将竭诚为您提供帮助。
内容中包含的图片若涉及版权问题,请及时与我们联系删除




评论
沙发等你来抢