DRUGAI
药物发现中,如何精准且高效地设计具有理想物理化学性质的潜在药物分子,对当前的研究水平来说仍然是一项重大挑战。近年来,基于深度学习的全新分子生成(de novo molecular generation)方法取得了显著进展,其中使用去噪扩散模型(denoising diffusion models)为生成框架的工作更是展现出极大潜力。然而,现有3D分子生成的方法往往难以同时优化多个分子性质,并且对于潜在药物分子的关键性质考虑不足,已开发的生成模型的应用能力仍有待提升。同时,直接采用原子距离分布嵌入图神经网络,无法准确捕捉分子的拓扑与几何信息。

基于此,澳门理工大学应用科学学院人工智能药物发现中心刘焕香教授和姚小军教授研究团队提出一种双去噪扩散模型 DiffMC-Gen(Dual Denoising Diffusion Model for Multi-Conditional Molecular Generation),通过结合离散与连续特征来增强模型对三维分子结构的感知能力,该成果发表在國際知名學術期刊《Advanced Science》上。模型采用多目标优化策略,能够同时优化目标分子的结合亲和力、药物相似性、合成可行性以及急性毒性。DiffMC-Gen 在生成分子的新颖性和唯一性方面达到了最新水平(SOTA),同时在药物相似性和合成可行性方面表现出与现有方法相当的性能。此外,DiffMC-Gen生成的分子在LRRK2、HPK1 和 GLP-1 受体三种靶点上均表现出良好的预测生物活性和药物特性,并保持较高的有效性、唯一性和新颖性。这些结果表明,DiffMC-Gen 具有用于新药设计的实际应用潜力。
背景
药物发现是一个极其复杂的过程,具有周期长、风险高、投入大等特点。近年来,计算机辅助药物设计(CADD)在新药开发的各个阶段展现出巨大潜力,极大地提高了药物研发的效率。然而,潜在药物分子的化学空间极为庞大,估计可达10⁶⁰个候选分子,使得寻找具有临床价值的化合物犹如大海捞针。此外,候选分子需要同时优化多个关键性质,如新颖性、独特性、药物相似性以及合成可行性,这为药物发现带来了巨大挑战。目前的实验策略通常仅优化高度相关的少数性质,且耗时较长。因此,如何有效地开发过程中对化合物进行多属性优化成为药物研发的关键问题。随着人工智能技术的快速发展,基于深度学习的分子生成模型为解决该问题提供了新的思路。
分子的三维几何结构是决定其物理化学特性的核心因素,直接影响其药理作用、药代动力学、代谢特性及毒性。因此,在三维空间中探索分子结构对于推动药物发现具有重要意义。图神经网络(GNNs)能够精准捕捉分子图的显式特征,使其在学习分子结构信息方面表现出色。目前,GNNs已整合多种生成策略,如自回归模型(autoregressive models)、基于潜在表征的模型(latent representation-based models)、等变归一化流(equivariant normalizing flows)及扩散模型(diffusion models),用于三维分子结构的生成。其中,扩散模型能够通过一系列扩散步骤有效学习数据的本质特征,从而构建更真实、更具细节的分子图,提升了分子生成的合理性,以此吸引了研究人员的广泛关注。
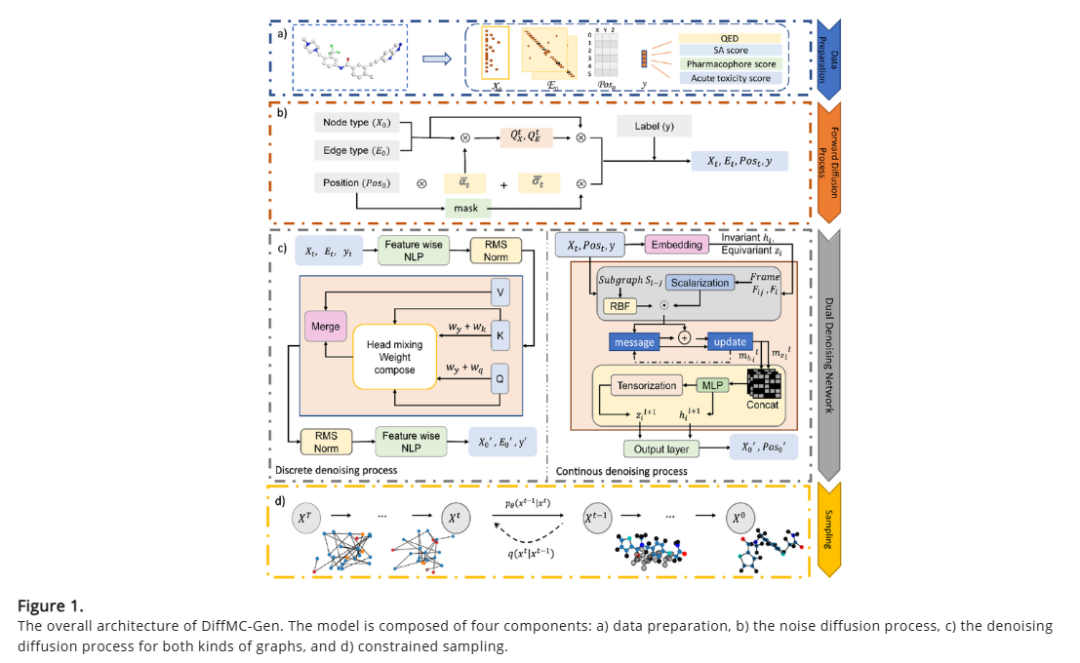
然而,当前基于扩散模型的3D分子生成方法很少关注候选药物的特殊性质,导致评估指标与实际应用脱节。此外,离散的分子图往往被嵌入到连续空间进行处理,使得关键信息在转换过程中丢失或模糊化。同时,该操作难以精准捕捉原子与化学键之间的关系,容易导致错误连接的出现。针对上述问题,研究人员提出了一种新型方法——DiffMC-Gen(Dual Denoising Diffusion Model for Multi-Conditional Molecular Generation),通过融合离散与连续去噪扩散模型来应对上述挑战。具体来说,该方法:
引入动态可组合多头注意力机制,优化离散图网络架构,有效减少网络参数,提高计算效率。
引入新型局部层级三维同构编码算法,用于精准捕捉分子几何信息,尤其是关键的空间特征。该算法在传统等变处理的基础上,额外考虑化学键角信息,并采用空间距离变换来确定化学键连接方式。
引入多目标优化策略,同时优化药效团匹配系数、急性毒性评估、药物相似性以及合成可行性,提高生成分子的药物相似性及潜在生物活性。
为了验证 DiffMC-Gen 的有效性,本研究以造血祖细胞激酶 1(HPK1)、富亮氨酸重复激酶 2(LRRK2)、胰高血糖素样肽 1 受体(GLP-1 receptor)为靶点进行案例研究。实验结果表明,DiffMC-Gen 生成的分子高度契合指定的药效团假设,并符合药物相似性标准,同时保持了较高的有效性、唯一性和新颖性。
该研究提出的 DiffMC-Gen 通过整合离散与连续扩散模型,提升了三维分子结构生成的精度与稳定性,并在多目标优化任务中展现出卓越性能。研究结果表明,该方法可为药物发现提供更加精准、高效的计算工具,为未来基于深度学习的分子生成研究提供新思路。
结果
DiffMC-Gen在2D 和3D分子的多条件约束的生成任务上的表现优异
为了全面评估分子生成模型的性能,本研究采用了三个数据集,包括Quantum Machine 9(QM9)、剑桥晶体数据库(Cambridge Structural Database,CSD,来自剑桥晶体学数据中心 CCDC)以及Molecular Sets(MOSES)。在这三个不同类型的数据集上训练生成模型,可评估其在不同分子分布和结构复杂度下的表现。这一策略有助于衡量模型的泛化能力、化学合理性及其在真实分子生成任务中的适用性,从而全面验证模型的实际价值。
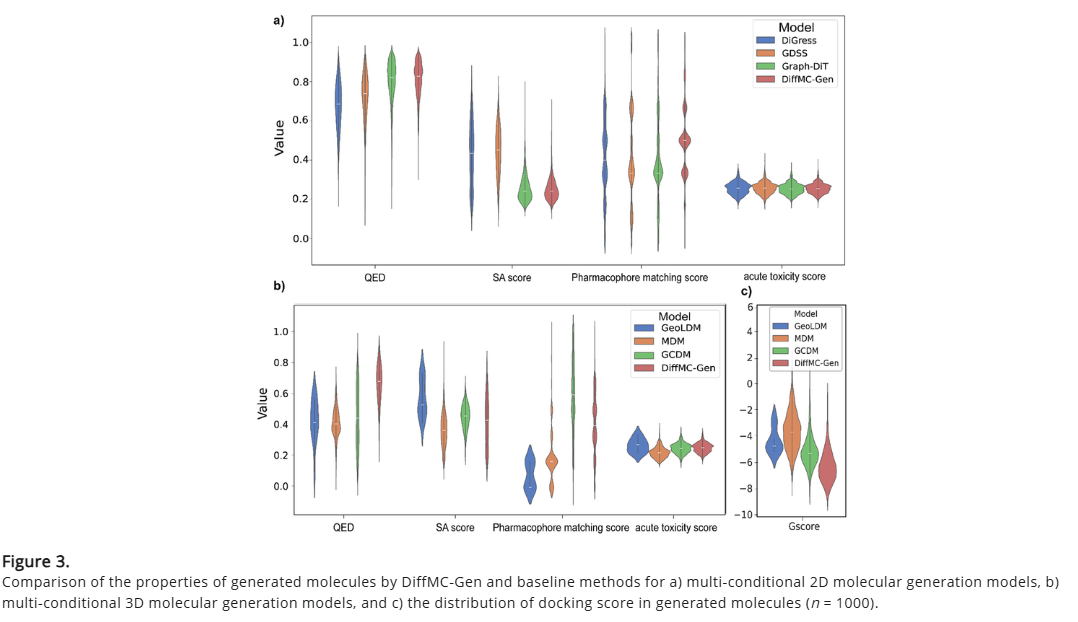
研究人员在三个数据集上评估了DiffMC-Gen 在多条件约束的情况下生成2D 和3D分子结构的能力,与当前代表性的几种生成模型在同样条件约束下得到的生成结果进行对比。在2D多条件分子生成任务中,DiffMC-Gen 优于现有基线模型,展现强大的药物相似性、合成可行性和药效团匹配能力。生成分子出现急性毒性的概率较低,确保分子安全性。DiffMC-Gen 具备多重约束优化能力,能够生成兼具创新性、药物相似性和低毒性的分子,为智能化药物设计提供强大支持。
DiffMC-Gen 在多条件3D分子生成任务中的表现优于现有基线模型,生成分子在药物相似性和药效团匹配方面均占优,展现出精准的局部结构捕捉能力与条件引导下的构象优化能力。此外,在急性毒性与合成可行性方面,DiffMC-Gen 与基线模型表现相当,表明其在优化3D分子的几何信息的同时,仍能有效控制分子结构复杂性。
进一步的分子对接实验显示,DiffMC-Gen 生成分子在 LRRK2 (PDB ID: 8FO7) 靶点上的对接打分分布优于所有基线模型,证明其能够优化分子构象,提高靶点结合能力。综上,DiffMC-Gen 不仅能够生成具有预期药物特性的分子,还能提升其靶向结合能力。
DiffMC-Gen 拓展药物化学空间
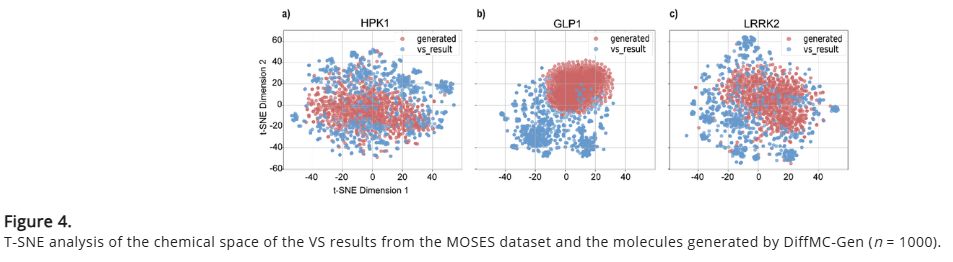
研究人员基于 MOSES 数据集 对 GLP-1 受体、HPK1 和 LRRK2 进行 虚拟筛选,采用 HTVS → Glide-SP → Glide-XP 的层次筛选策略,最终保留 1,000 个分子作为基准。与生成数据集的T-SNE 可视化显示,对于 HPK1 和 LRRK2,生成分子聚集在不同区域,表明其在保留关键子结构的同时探索了新的结合模式。对于 GLP-1 受体,生成分子与筛选分子的分布更具差异性,意味着更高的新颖性,这可能与 GPCR 受体保守的结合口袋相关。这些结果证明,DiffMC-Gen 能够有效探索区别于现有筛选数据集的新颖分子。
DiffMC-Gen 生成高活性分子,优化靶点结合模式
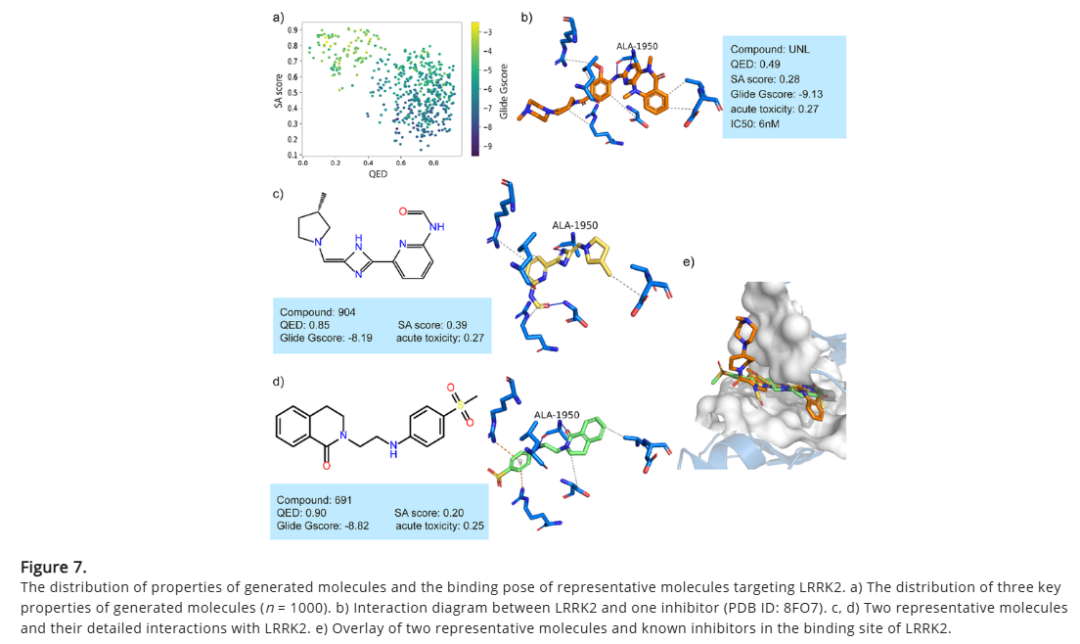
对高分对接分子的关键相互作用分析,有助于评估其潜在生物活性。本研究以造血祖细胞激酶 1(HPK1)、富亮氨酸重复激酶 2(LRRK2)、胰高血糖素样肽 1 受体(GLP-1)为靶点进行案例研究。结果表明,DiffMC-Gen 可生成高结合亲和力、低合成复杂度、良好药物相似性的分子。研究人员在每个测试案例中选取了两种代表性分子,并展示其与靶点的相互作用模式。对相互作用的分析结果反映出,DiffMC-Gen 不仅能够学习已知激动剂或抑制剂的关键结合模式,还能优化相互作用,探索新的结构设计以增强靶点结合亲和力。
结论
本研究系统性地评估了 DiffMC-Gen 在多条件 2D 和 3D 分子生成任务中的能力,验证了其在药效团匹配情况、急性毒性概率、药物相似性和合成可行性之间的平衡能力,并能有效地结合条件指导优化生成结果。与基线模型的对比分析表明,DiffMC-Gen 在探索新化学空间和优化目标分子性质方面具有显著优势。通过 药效团引导和 3D 结构约束,DiffMC-Gen 不仅能重现已知分子的结合模式,还能生成具有其他相互作用模式的新型分子。未来的研究方向包括拓展至更多靶点、结合蛋白-配体相互作用预测模型,以及引入主动学习策略,以实验数据进一步优化生成性能,以期推动深度学习在智能化药物设计中的应用。
参考资料
Y. Yang, S. Gu, B. Liu, X. Gong, R. Lu, J. Qiu, X. Yao, H. Liu, DiffMC-Gen: A Dual Denoising Diffusion Model for Multi-Conditional Molecular Generation. Adv. Sci. 2025, 2417726.
http://doi.org/10.1002/advs.202417726
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢