DRUGAI
今天为大家介绍的是来自华盛顿大学医学院Tao Che与Susruta Majumdar团队发表的一篇论文。慢性疼痛和阿片类药物过量死亡凸显了对新型无成瘾性镇痛药的需求。δ阿片受体(δOR)是一个有前景的靶点,因为它不会引发与µ阿片受体(µOR)激动剂相关的呼吸抑制。然而,早期δOR全激动剂会导致癫痫,限制了其临床应用。相比全激动剂,δOR部分激动剂可能提供更温和的受体激活,但由于对其部分激动作用的分子机制尚不清楚,其发展受到阻碍。本研究通过结构基础设计开发了一种双位配体C6-Quino,作为选择性δOR部分激动剂。功能研究表明,C6-Quino在G蛋白和arrestin信号途径中表现出不同的活性,并且通过冷冻电镜(cryo-EM)分析确认其与钠结合口袋相互作用。C6-Quino显示出口服活性,在慢性疼痛模型中具有镇痛效果,同时不会引发δOR相关的癫痫或µOR相关的不良反应,这些不良反应近年来限制了阿片类药物的使用。

阿片类药物通过激活µ阿片受体(µOR)有效缓解急性疼痛,但过度依赖µOR激动剂引发了公共卫生危机,因其会导致肠道功能减弱、止痛效果下降、成瘾风险以及可能致命的呼吸抑制。相比之下,δ阿片受体(δOR)被认为是更安全的替代目标,具有三大优势:
慢性疼痛时δOR表达增多;
δOR激动剂避免了µOR激动剂的多种副作用;
对头痛和偏头痛有良好效果。
然而,第一代δOR激动剂如BW373U86、SNC80高剂量时会引发癫痫,后续的ARM390和ADL5859虽不会引发癫痫,但ARM390长期使用后止痛效果减弱,ADL5859在膝关节炎二期临床试验中未能达到预期目标。(±)-TAN67因作用不够专一而表现不稳定。新开发的G蛋白偏向δOR激动剂TRV250和PN6047已通过一期临床试验,但其具体作用机制仍需探索。研究发现,降低G蛋白激活效能可能减少副作用,部分激动剂因仅引发亚最大反应,可能更安全,但其分子基础尚不清楚。
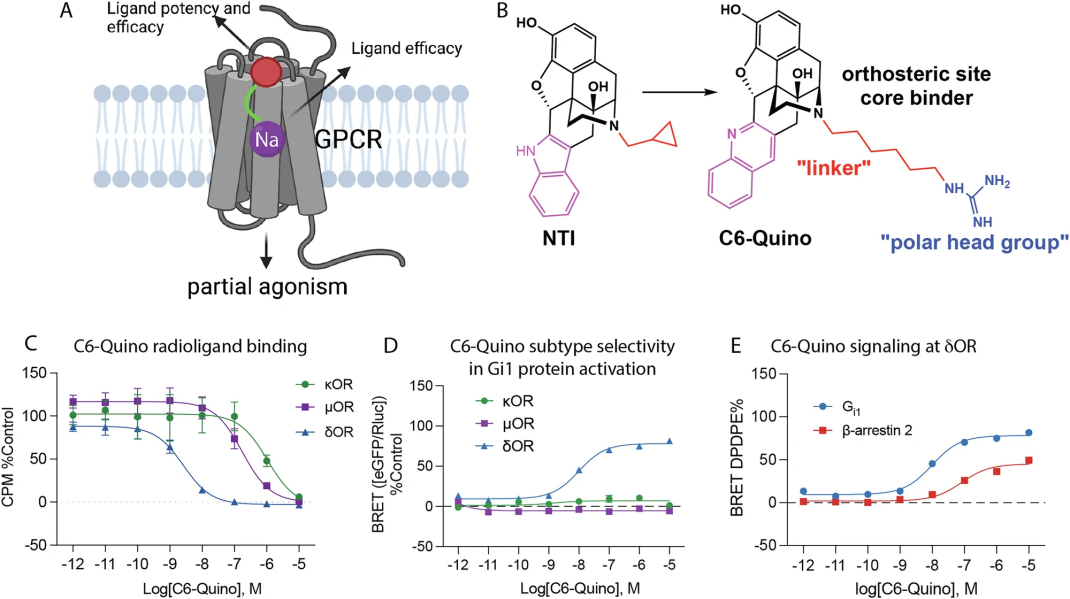
图 1
最近,科学家发现Class A GPCR中的钠位点能调控信号方向,基于此研究团队设计了C6-Quino(图1A),一种选择性δOR部分激动剂,作为双位配体同时作用于正位点和钠位点。实验表明C6-Quino在体外表现为部分激动剂,cryo-EM结构确认它与钠位点相互作用。在小鼠慢性疼痛模型中,C6-Quino展现出止痛效果,且不会引发癫痫或明显的呼吸抑制。
通过靶向原位位点开发选择性δOR双位配体
为了精准激活人体δ阿片受体(δOR),研究团队以已知的δOR拮抗剂NTI的吲哚结构为起点设计激动剂。NTI的高分辨率X射线晶体结构(PDB: 4N6H)揭示,其基本胺与钠结合位点的D952.50残基相距11.2Å。为同时作用于正位点和钠结合位点,研究团队将NTI的环丙基甲基替换为带胍基的脂肪链连接子(Cn,n=3、5、6、7),形成C3至C7-guano系列的双位配体,其中胍基作为极性头部发挥作用。图1B展示了NTI核心结构的氮原子调整。研究团队发现,C5-Indole(5碳连接子)和C6-Indole(6碳连接子)能有效结合钠位点,其中C5-Indole对δOR的选择性是κOR的50倍,C6-Indole达90倍,且两者对µOR无激动作用。但C6-Indole在κOR仍有35%的部分效能,因此研究团队将吲哚改为喹啉,进一步提升选择性。计算模型表明,喹啉能适应δOR的疏水区域(由V6.55、W6.58、L7.35构成),而µOR和κOR因含有极性残基(K6.58、E6.58及W7.35、Y7.35)与之不相容。实验验证,C6-Quino对δOR高效,对κOR和µOR无信号。如图1C所示,研究团队结合亲和力实验确认了其选择性。
通过靶向别构钠位点调节δOR配体的药效
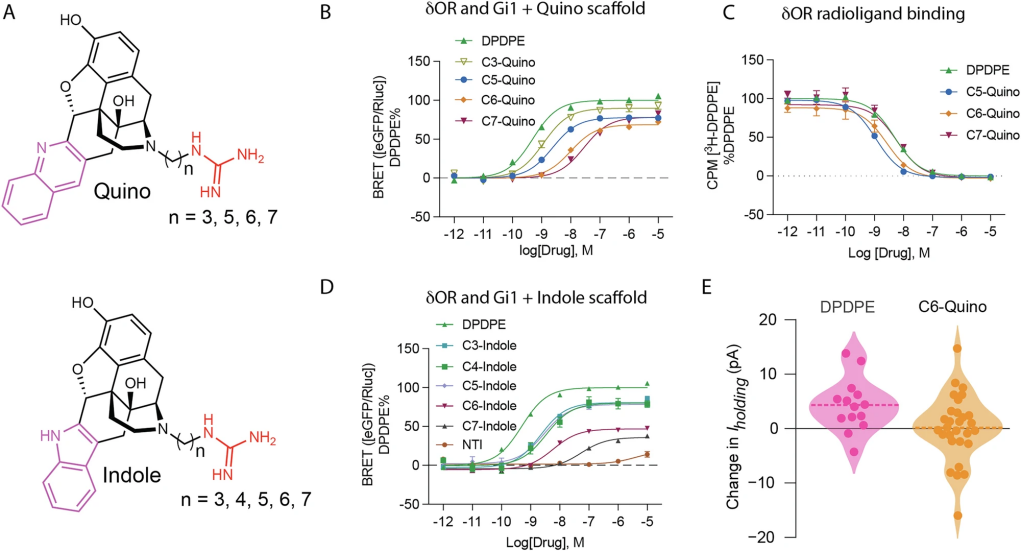
图 2
通过靶向δ阿片受体(δOR)的变构钠位点,研究团队希望设计出在Gi1蛋白信号通路中强效、而在arrestin通路中低效能的部分激动剂。研究发现,双位配体的效力与效能会因连接子长度不同而显著变化。例如,C3-、C5-、C6-Quino对Gi1显示高效力(EC50分别为1.2nM、2.4nM、9.9nM),而C7-Quino效力下降(EC50为28nM)。C3-Quino的效能接近全激动剂(Emax=90±3%),而C5-、C6-、C7-Quino作为部分激动剂,其效能分别为78±2%、69±2%、78±2%(图2A, B)。在β-arrestin1募集上,C5-、C6-、C7-Quino的效力随连接子变长逐渐降低。C5至C7衍生物对δOR的结合亲和力相近(图2C)。研究团队选定C6-Quino作为首选,因其对δOR选择性高,效力适中,且在arrestin亚型效能较低。在人和鼠的δOR中,C6-Quino的Emax分别为68%和70%,效力保持纳摩尔水平。在鼠脑VTA神经元的电生理实验中,10μMC6-Quino的电流变化接近0 pA,与全激动剂DPDPE相比,表明其体内反应温和,符合部分激动特性(图2E显示了电流变化数据)。
δOR与双位配体结合的低温电镜结构
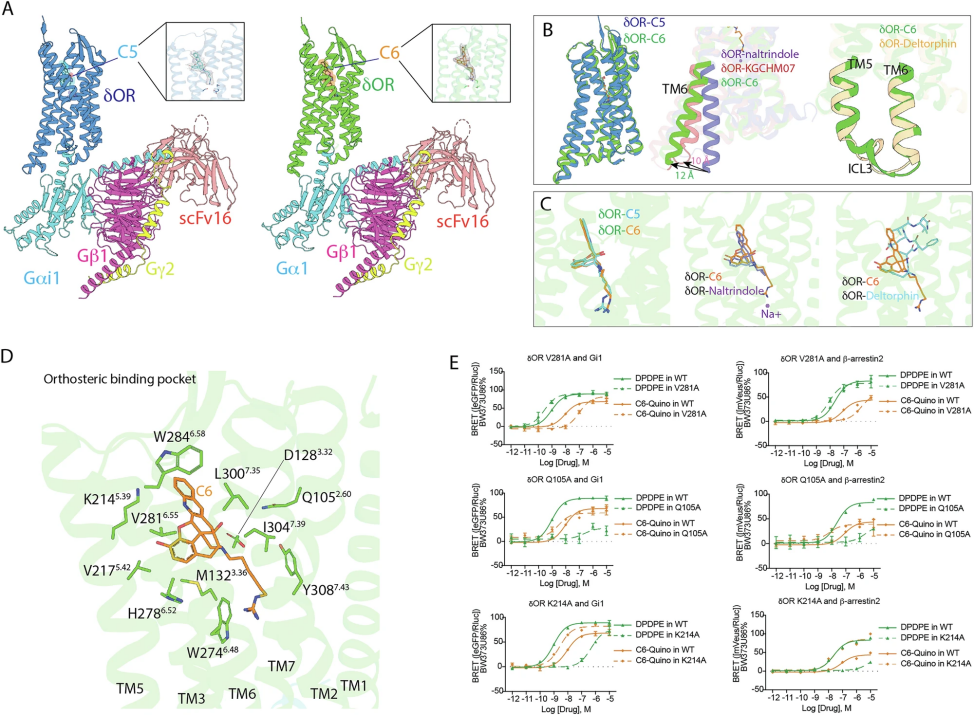
图 3
为了确认双位配体与δ阿片受体(δOR)钠位点的结合,研究团队解析了C5-Quino和C6-Quino与δOR的cryo-EM结构,分辨率分别为2.62Å和2.80Å(图3A)。复合物包含δOR、C5-或C6-Quino及Gαi1、Gβ1、Gγ2三聚体,由scFv16稳定,未引入热稳定突变。两者的结构均显示全激活状态,构象高度一致,尽管C6-Quino是部分激动剂(图3B)。相比NTI结合的非激活态(PDB: 4N6H),TM6向外移动12Å,这是GPCR激活的典型特征,而C6-Quino的TM6比KGCHM07结合态(PDB: 6PT3)多移2Å(图3B)。无Na+时,D2.50可能带正电,但配体的胍基与D2.50相互作用,阻止这一变化,保持结合口袋的开放状态。与全激动剂deltorphin相比,C6-Quino的TM5、TM6位置相近,但ICL3构象更稳定,可能增强复合物稳固性。两配体同时占据正位点和钠位点(图3C),C6-Quino在正位点与NTI相似,但与deltorphin仅酚基指向TM5。C6-Quino的喹啉通过与ECL3的W2846.58形成π-π作用增强选择性(图3D)。突变实验发现,Q1052.60A和K2145.39A显著提升C6-Quino的Gi1和β-arrestin2活性,而V2816.55A降低其活性却增强DPDPE活性(图3E中的突变效应)。
与钠位点的直接相互作用具有独特的活性状态
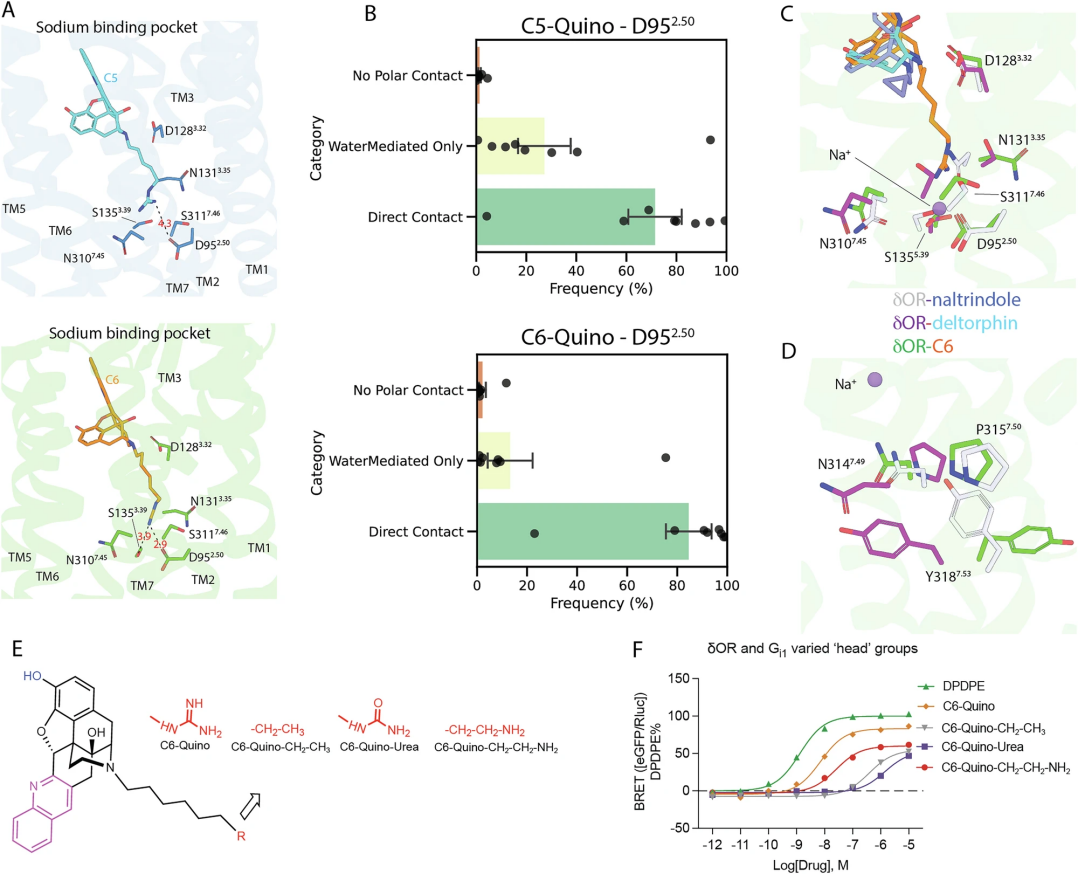
图 4
胍基延伸到δ阿片受体(δOR)的钠位点,改变了其内部残基的排列方式(图4A),但C5和C6因连接子长度不同,影响有所差异。钠位点由酸性和极性残基D952.50、N1313.35、S1353.39、N3107.45、S3117.46组成,在非激活态下稳定Na+,激活时这些残基重新排列,Na+被排出。C6-Quino与D952.50形成2.9Å的氢键,并与S1353.39保持3.9Å的联系;而C5-Quino因连接子较短,与D952.50仅形成4.3Å的弱作用,无其他直接接触。分子动力学模拟显示,C6-Quino与D952.50的“直接接触”占84%(水介导仅14%),C5-Quino为70%(水介导27%)(图4B),C6-Quino的盐桥距离略短(3.0Å vs 3.2Å)。C5-Quino常通过水分子间接连接D952.50、N3107.45或S1353.39,这种水介导作用持续时间更长,意味着更稳定的间接联系。与NTI结合态相比,C6-Quino结合时N1313.35等残基侧链移动2.8Å(图4C),较deltorphin结合态更显著,可能因胍基干扰电荷作用。邻近钠位点的NPxxY基序也因此呈现独特构象(图4D中的NPxxY变化),而DRY基序未见明显改变。为验证钠位点影响,研究团队合成了中性脲类(C6-urea)、胺类(C6-quino-CH2CH2NH2)和无功能团(C6-quino-CH2CH3)化合物(图4E),其Gi1效力显著下降,arrestin活性也减弱(图4F)。
C6-Quino表现出δOR依赖的抗异常性疼痛效果,且无不良反应
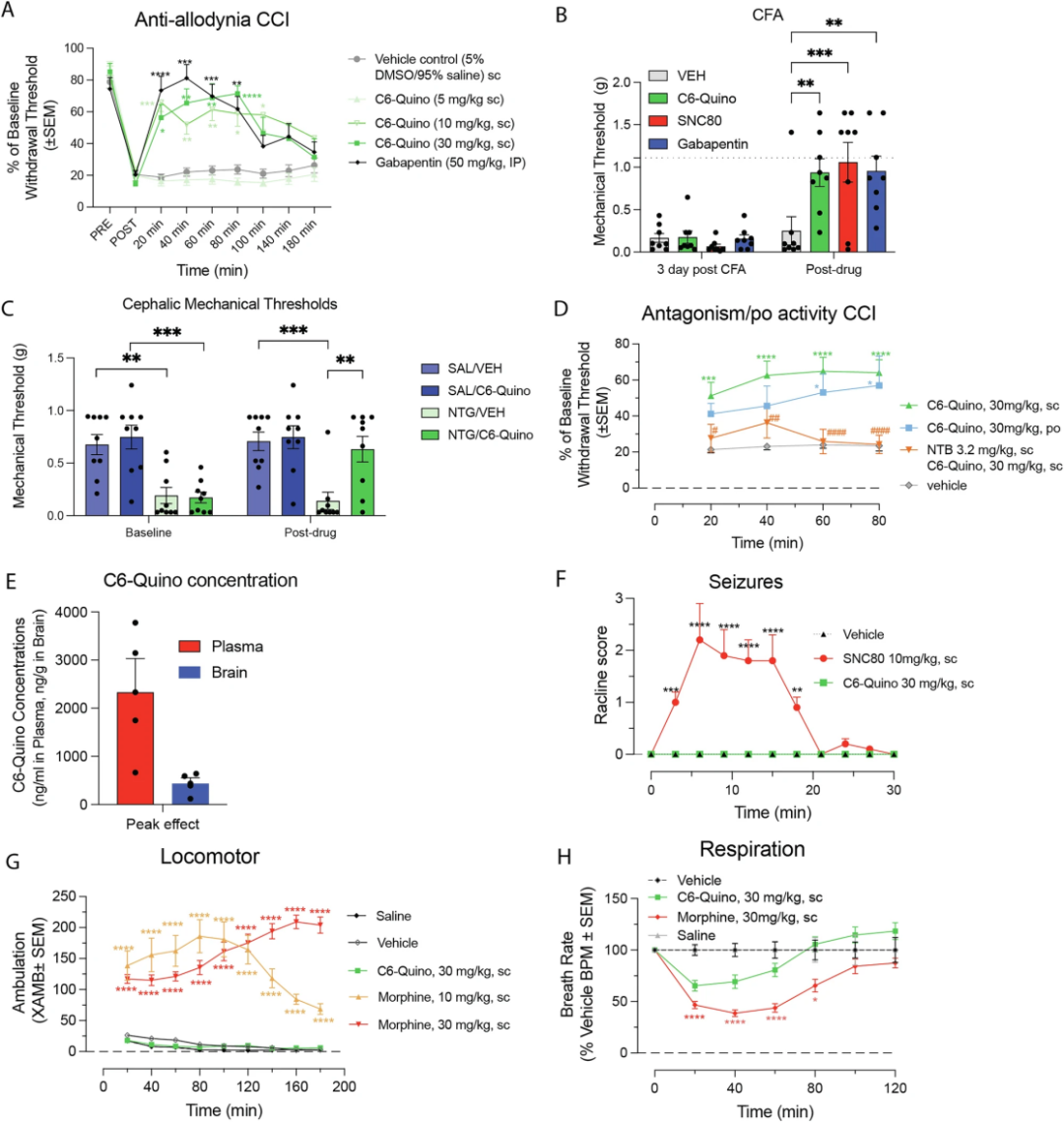
图 5
为了探索部分激动剂C6-Quino在体内的潜力,研究团队在小鼠中进行了实验。在慢性缩窄损伤(CCI)模型中,C6-Quino皮下注射(sc.)30mg/kg,能按剂量逐步抑制机械性异常疼痛,效果持久(图5A)。它在使用相同剂量时,还能减轻完全弗氏佐剂(CFA)引发的外周痛觉过敏和硝酸甘油(NTG)引发的头部异常疼痛,效果媲美典型δ阿片受体(δOR)激动剂SNC80(10mg/kg, sc.)(图5B, C)。口服30mg/kg的C6-Quino在CCI模型中同样有效,与皮下注射效果相当(图5D)。为验证δOR的作用,研究团队先给小鼠皮下注射δOR拮抗剂 naltriben(NTB, 3.2mg/kg)10分钟后再测试C6-Quino(30mg/kg, sc.),发现 NTB 明显减弱其止痛效果,证明δOR是主要靶点(图5D)。药代动力学显示,皮下注射30mg/kg后80分钟,血浆浓度约1200ng/ml,脑血比1:6,脑内浓度远超激活δOR所需的水平(图5E)。考虑到δOR激动剂可能引发癫痫,研究团队比较了C6-Quino(30mg/kg, sc.)与SNC80(10mg/kg, sc.),SNC80引发20分钟癫痫,而C6-Quino无此反应(图5F)。C6-Quino(30mg/kg, sc.)不影响运动水平,吗啡(10或30mg/kg, sc.)则显著增加运动(图5G)。呼吸测试显示,C6-Quino无明显呼吸抑制,吗啡则相反(图5H)。总之,C6-Quino通过靶向钠位点实现止痛,且避免了常见的阿片类副作用。
讨论
慢性疼痛治疗亟需安全有效的镇痛药,以规避传统阿片类药物的副作用和成瘾性。δ阿片受体(δOR)激动剂在慢性疼痛模型中展现潜力,且无µOR激动剂的呼吸抑制和成瘾等副作用,但早期δOR激动剂如SNC80易引发癫痫,限制了其应用。本研究通过结构导向设计,开发了靶向正位点和钠结合位点的δOR部分激动剂C6-Quino。C6-Quino在体内表现出显著止痛效果,且无癫痫、运动障碍等副作用。研究表明,钠位点相互作用能调节信号效能,为开发更安全、高效的镇痛药开辟了新途径。
编译|于洲
审稿|王梓旭
参考资料
Che T, Varga B, Bernhard S M, et al. Structure-Guided Design of Partial Agonists at an Opioid Receptor[J]. Research Square, 2024: rs. 3. rs-4664764.
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢