
华东师范大学药学院/人工智能新药创智中心李洪林/李诗良教授团队、香港中文大学(深圳)医学院杜洋研究员团队、武汉大学徐可教授团队联合海军军医大学等于2025年4月26日在国际学术期刊Advanced Science发表题为“Dual-Locking the SARS-CoV-2 Spike Trimer: An Amphipathic Molecular “Bolt” Stabilizes Conserved Druggable Interfaces for Coronavirus Inhibition”的研究论文。

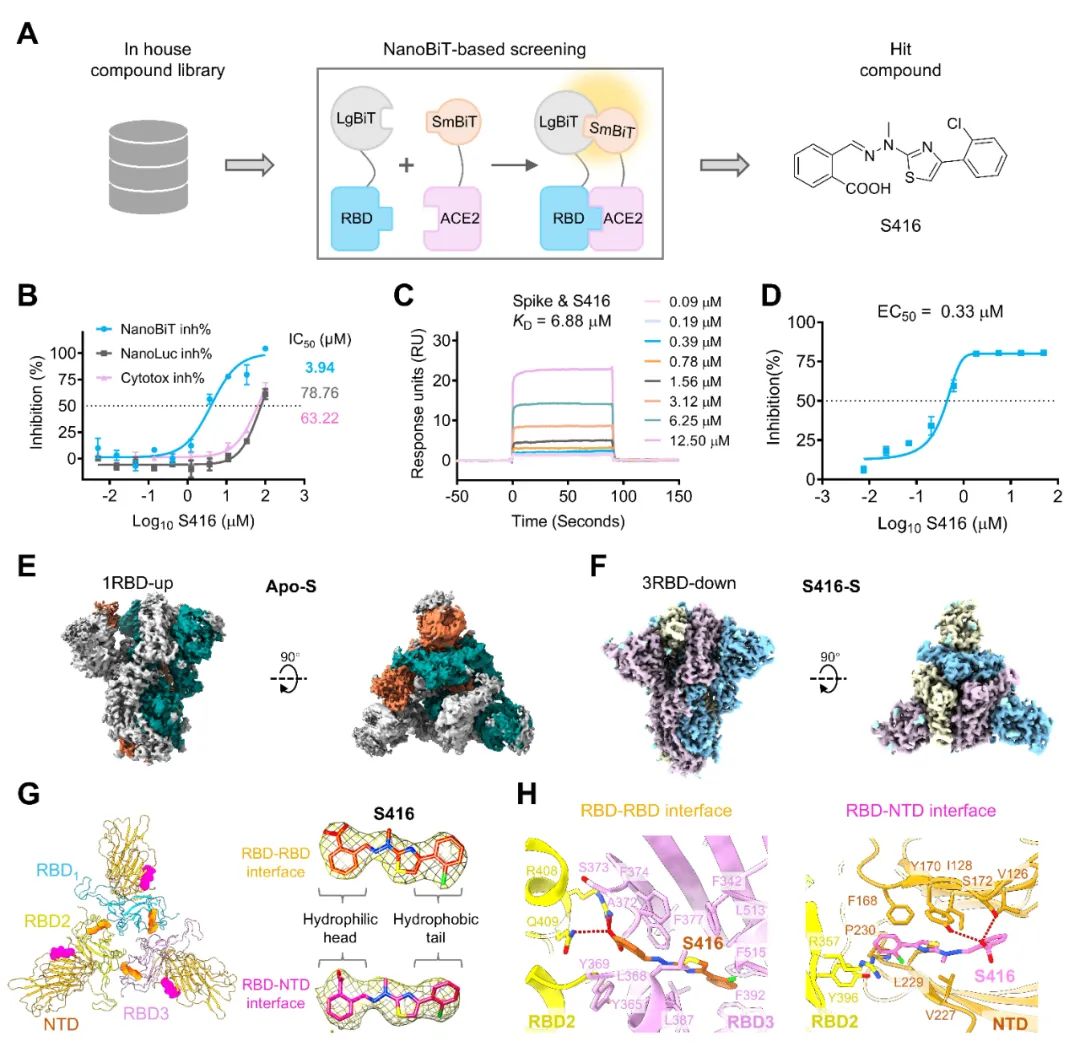
研究团队成功解析并验证了新型两亲性小分子S416的抗病毒机制——这种仿生设计的智能“分子螺栓”通过协同结合刺突蛋白三聚体界面的两个变构位点发挥双重锁扣效应,将新冠病毒S蛋白强力锚定于非活化的关闭构象,形成受体结合域'全封闭锁'。冷冻电镜与分子动力学模拟证实,该化合物可完全阻断S蛋白与ACE2受体的互作界面,作用位点在SARS-CoV、MERS-CoV等β冠状病毒中高度保守,为开发克服病毒逃逸的广谱抗冠状病毒药物提供了一种全新的技术路径。新冠病毒表面的刺突蛋白是病毒入侵宿主细胞的关键武器。它像一把钥匙,需要从“关闭”(down)构象转变为“开放”(up)构象,才能结合人体细胞表面的ACE2受体,介导病毒进入细胞。阻止刺突蛋白的这种构象变化,将其稳定在“关闭”状态,是开发抗新冠药物的重要策略。然而,刺突蛋白的高度动态性和易突变性给药物设计带来了巨大挑战。该研究发现:
研究团队通过理性设计策略筛选出新型噻唑骨架化合物S416,其独特的极性头基-疏水尾链两亲性结构,可精准模拟天然蛋白相互作用。结合S416的刺突蛋白被全封闭态固化:刺突蛋白三聚体被锁定在全RBD向下构象(3 RBD-down),电镜分类中完全无开放态粒子。分子动力学模拟显示,S416结合后刺突蛋白整体刚性增强,关键受体结合基序(RBM)的原子波动性显著降低。S416显著抑制假病毒对ACE2表达细胞的附着/进入,EC50为0.33 µM;实验也证实其能抑制野生型及奥密克戎XBB、EG.5亚变体的感染和细胞融合。药代动力学数据显示,该分子具备76.28%的口服生物利用度(大鼠模型),急毒试验中未观察到显著器官病理损伤(最高剂量500 mg/kg),具备候选药物潜力。刺突蛋白由三个单体组成的同源三聚体发挥功能,与已有的三聚体抑制策略不同(如亚油酸LA仅靶向RBD-RBD单体间界面),通过2.95 Å冷冻电镜结构(PDB 9LVS),团队首次揭示:每个S416分子同时楔入①相邻RBD结构域间的疏水腔(单体间界面)与②NTD-RBD电荷互补区(单体间界面),实现双界面协同锚定Spike闭合态瞬时构象——每个刺突蛋白三聚体精准结合6个S416分子(两种界面各3个),形成几何对称的六螺栓拓扑锁定,导致刺突三聚体整体结构变的更紧凑(相比Apo状态,①整体尺寸减小:高度从91.1 Å减至86.7 Å,宽度从84.7 Å减至83.1 Å;②结构域向中心轴收紧:RBD核心距中心轴缩短约12 Å,NTD核心距中心轴缩短约6 Å)。3. 新的广谱抗病毒靶点
研究揭示S416的独特优势:其作用的双界面在SARS-CoV、MERS-CoV、HCoV-OC43等β冠状病毒中高度保守,病毒在双界面同时产生耐药突变的概率低于单靶点抑制剂。S416对上述冠状病毒的Spike蛋白均保持结合能力。这意味着S416不仅对新冠病毒及其变异株有效(实验已证实其能抑制野生型及奥密克戎XBB、EG.5亚变体的感染和细胞融合),更有潜力发展成为一种广谱抗冠状病毒药物,应对未来可能出现的新发或再现的冠状病毒威胁。图2 S416分子通过靶向RBD-RBD和RBD-NTD界面锁定刺突蛋白[1]这项研究首次揭示刺突蛋白三聚体分子内、外界面为潜在成药性靶点,破解"构象动态性导致难以靶向"的难题,发现并验证了小分子S416通过创新的“双重锁扣”机制稳定新冠病毒刺突蛋白,并具有广谱抗病毒潜力,为药物设计从"追随变异"到"超前防御"的广谱候选靶点提供新的思路。
华东师范大学药学院/人工智能新药创智中心李诗良研究员,香港中文大学(深圳)医学院叶芳博士,武汉大学生命科学学院博士生郑雨澄,华东理工大学药学院博士生王洁,海军军医大学彭浩然博士为本文共同第一作者。该工作得到了国家自然科学基金“基于冠状病毒感染与致病共性机制的创新药物研究” 指南引导类原创探索计划项目(82150208),及其他国家自然科学基金(82425104,82341056,82272307,32300138)和国家重点研发计划(2022YFC3400500,2023YFC2307800)等项目资助。
[1] S. Li, F. Ye, Y. Zheng, J. et al. Dual-Locking the SARS-CoV-2 Spike Trimer: An Amphipathic Molecular “Bolt” Stabilizes Conserved Druggable Interfaces for Coronavirus Inhibition. Advanced Science. 2025, 2417534.[2] Toelzer C, Gupta K, Yadav S K N. et al. Free fatty acid binding pocket in the locked structure of SARS-CoV-2 spike protein. Science. 2020, 370(6517): 725-730.原文链接:http://doi.org/10.1002/advs.202417534
华东师范大学药学院/人工智能新药创智中心/李洪林教授课题组Li's Lab课题组网站:http://www.lilab-ecust.cn
内容中包含的图片若涉及版权问题,请及时与我们联系删除









评论
沙发等你来抢