在癌症治疗领域,基因疗法一直备受关注。2025年5月8日,一项发表于《Nature Communications》的研究成果为我们带来了新的希望。该研究由军事医学研究院钟武,曹瑞源,李松团队完成,题为 “Gene Therapy with Enterovirus 3 C Protease: A Promising Strategy for Various Solid Tumors”,揭示了利用肠道病毒 3C 蛋白酶的基因疗法在多种实体瘤治疗中的巨大潜力。

溶瘤病毒对肿瘤细胞具有高效杀伤活性,但这种基于活毒的抗肿瘤策略存在预存抗体、细胞因子风暴等潜在疗效和安全性隐患,从而限制了其在临床中的应用。而病毒中的非结构蛋白酶是关键的毒力因子,它可以靶向识别并切割特定的宿主蛋白,从而干扰细胞的生理功能,导致细胞自噬、细胞凋亡等病理后果。然而,这些非结构蛋白酶在抗肿瘤治疗中的潜力尚未得到充分挖掘和验证。
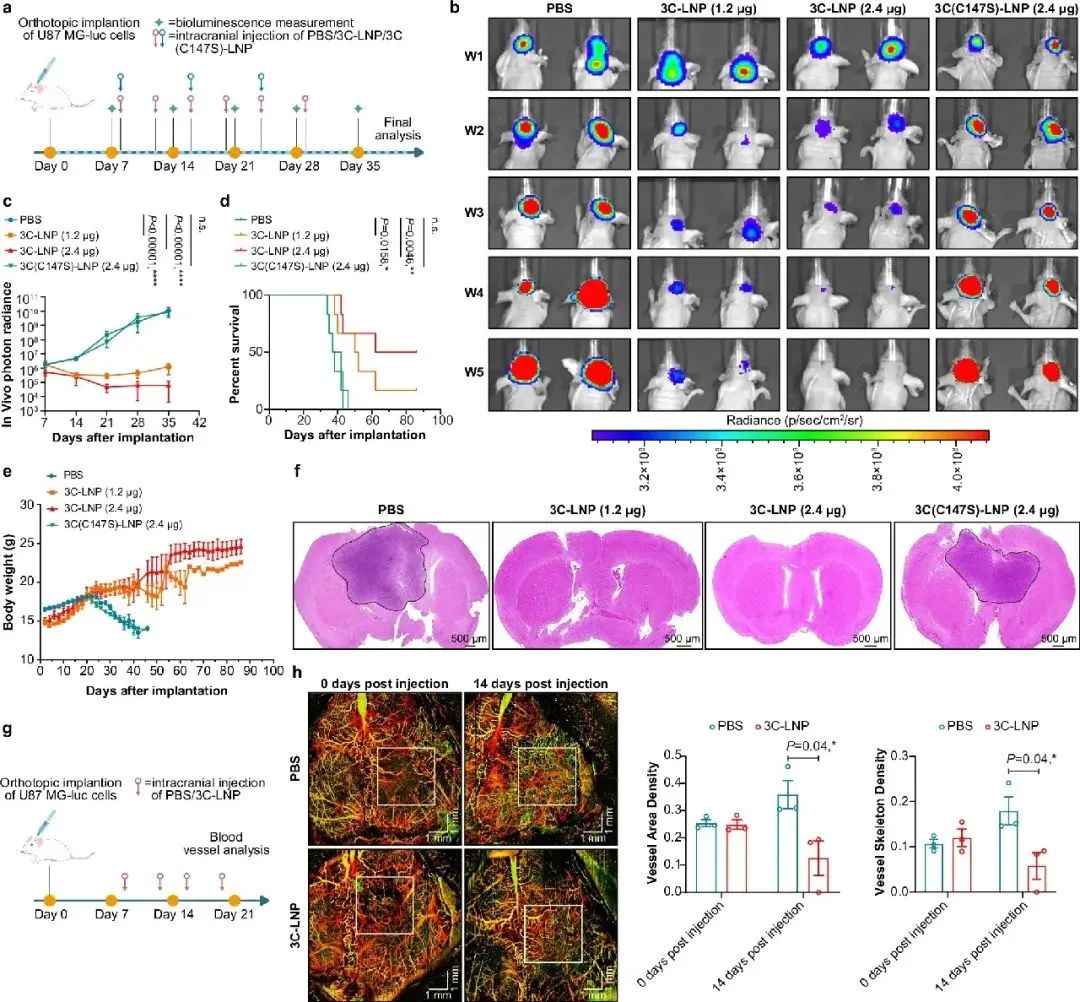
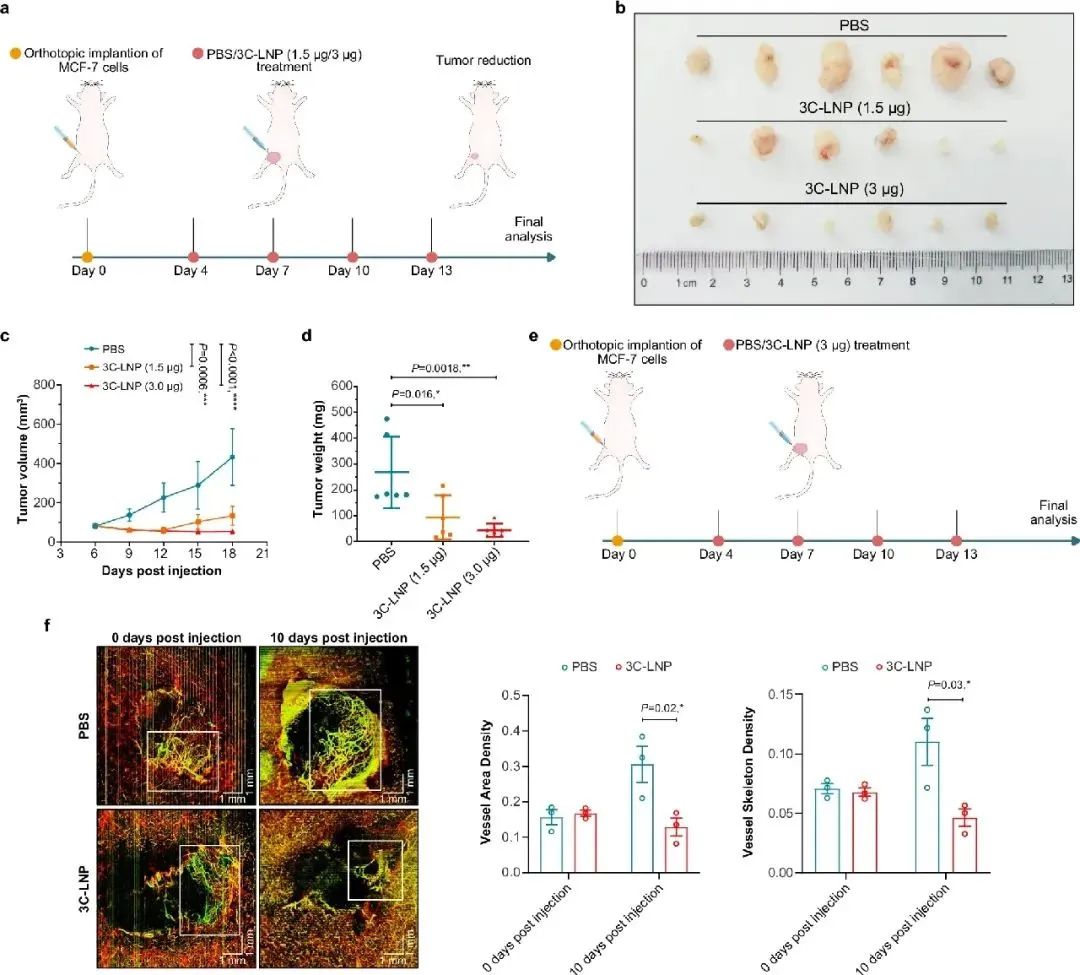
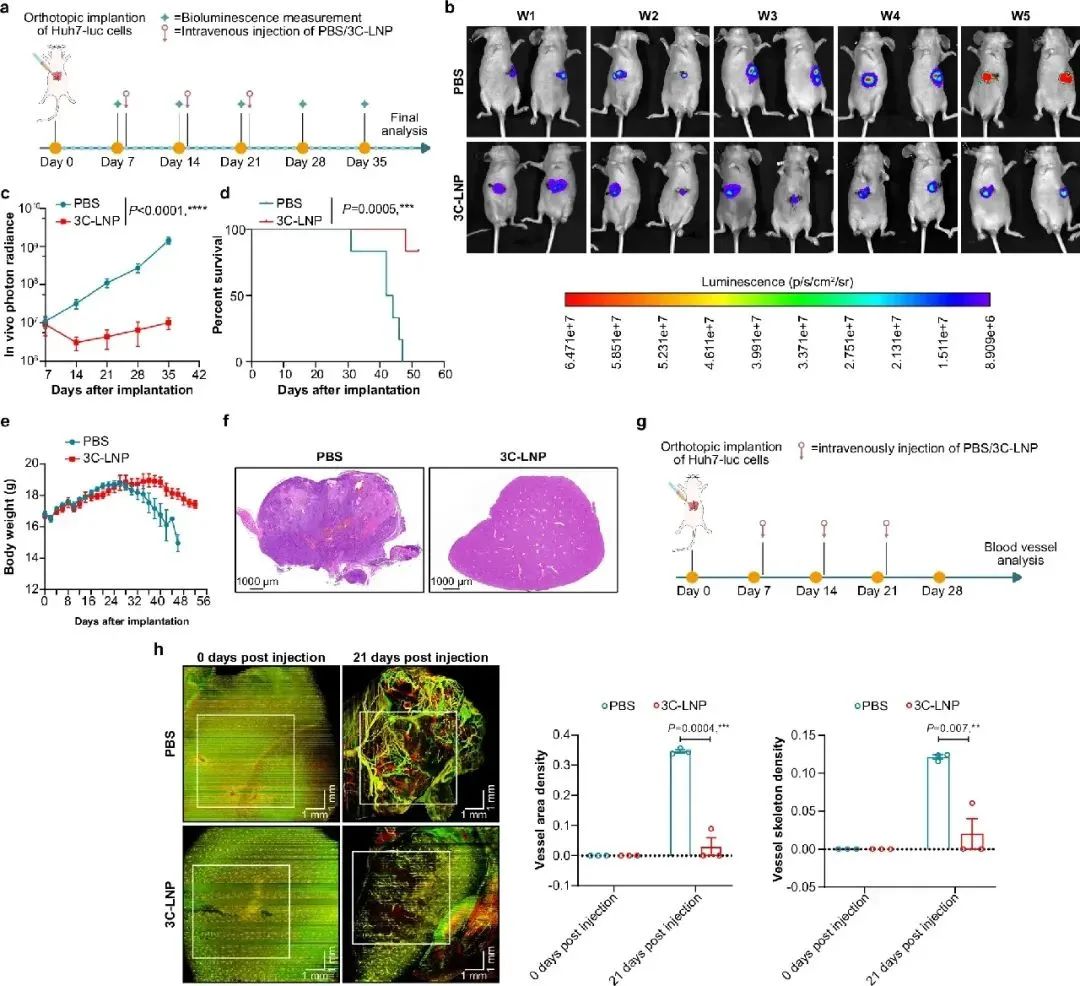
研究团队创新性地将编码病毒3C蛋白酶的mRNA装载进脂质纳米颗粒 (3C-LNPs),通过多种给药途径(颅内、皮下和静脉注射)在多种实体瘤模型中展开研究,包括胶质母细胞瘤、乳腺癌和肝细胞癌模型。实验结果令人振奋,3C-LNPs 能够高效抑制肿瘤生长,延长肿瘤负荷小鼠的生存时间。在胶质母细胞瘤模型中,与对照组相比,接受 3C-LNPs 治疗的小鼠肿瘤生长显著受到抑制,生存率得到显著提高(图1);在乳腺癌模型中,皮下注射 3C-LNPs 可减少肿瘤体积,抑制肿瘤血管生成(图2);而在肝细胞癌模型中,静脉注射 3C-LNPs 不仅抑制了肿瘤生长和血管生成,还延长了小鼠的生存时间(图3)。同时,研究采取多种体内模型证实,将3C-LNP以上述多种给药途径注射入正常小鼠体内具有良好的安全性。
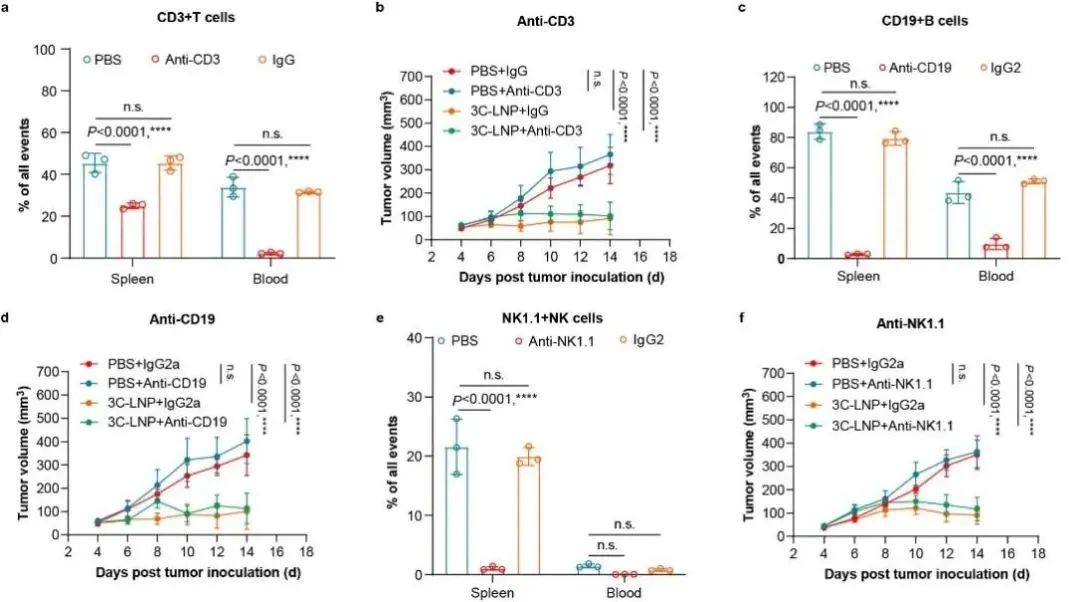
T/B/NK细胞耗竭实验进一步证实了3C-LNPs的抗肿瘤效果是不依赖免疫系统(图4)。通过对肿瘤体积的连续监测结果显示,研究人员发现,T/B/NK免疫细胞的耗竭并没有对3C-LNPs的抗肿瘤效果产生任何负面影响。这一发现表明,3C-LNPs的抗肿瘤活性可能独立于这些特定的免疫细胞群体,暗示了其可能通过其他机制直接对肿瘤细胞产生杀伤作用。
通过质谱分析和切割位点预测实验,研究人员发现异质性核糖核蛋白 A1 (hnRNP A1) 是 3C 蛋白酶的主要降解靶点。这一发现进一步揭示了该基因疗法的潜在作用机制,即 3C 蛋白酶通过特异性切割 hnRNP A1 蛋白,发挥其抗肿瘤效果。对本研究的总结如示意图5,肠道病毒3C蛋白酶mRNA可诱导细胞凋亡从而抑制肿瘤的生长。携带肠道病毒3C蛋白酶mRNA的LNPs进入细胞后,所表达的3C蛋白酶通过直接切割下调hnRNP A1,解除hnRNP A1对Apaf-1的抑制,激活Caspase-3,上调Cleaved-caspase-3,从而有效地诱导肿瘤细胞的凋亡。颅内原位给药、皮下给药以及尾静脉给药三种给药途径在不同的小鼠肿瘤模型中均显示出较高的体内疗效。
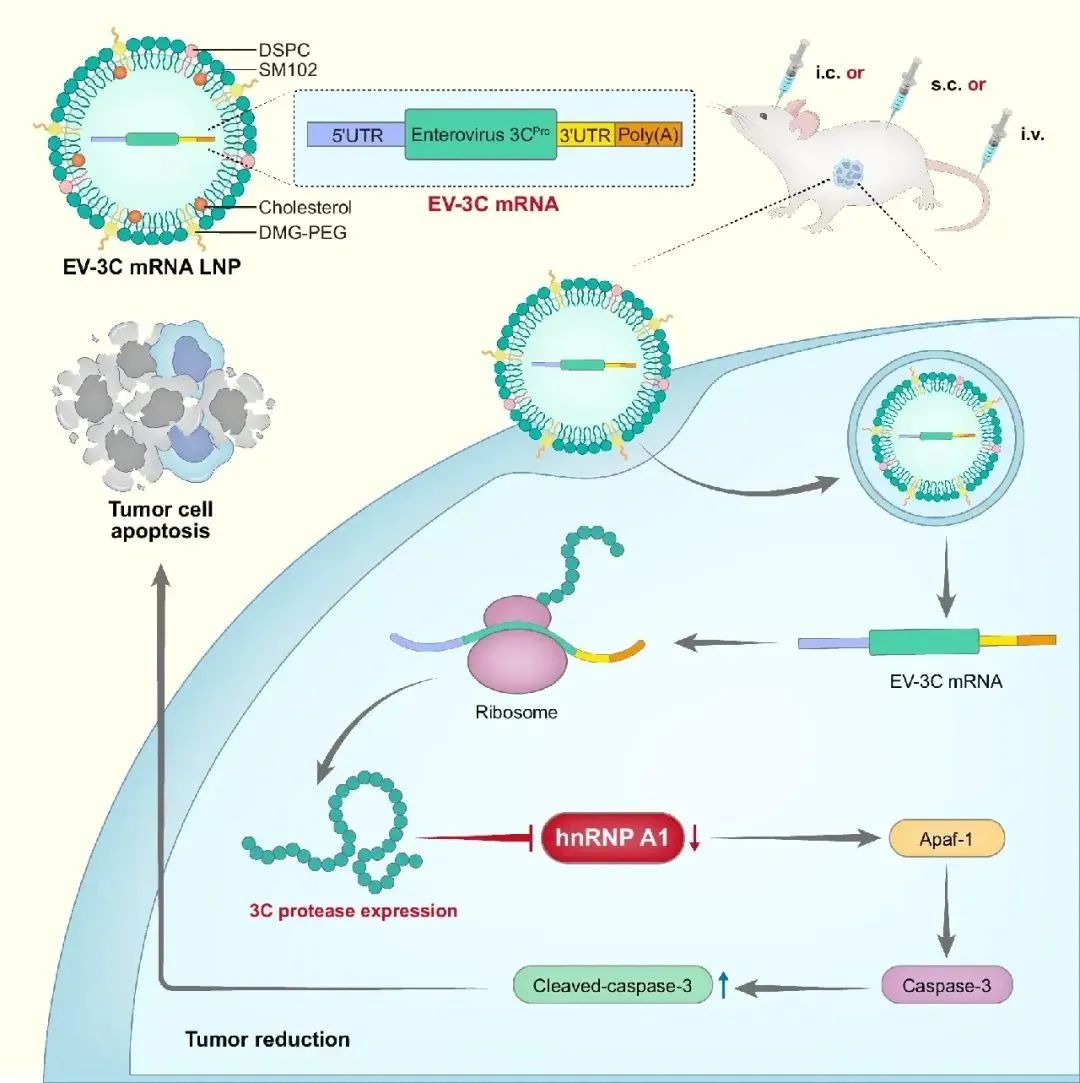
本研究不仅为实体瘤治疗提供了一种全新的基因疗法策略,还极大地拓宽了 mRNA-LNP 抗肿瘤应用的范围。该策略的优势在于其直接作用于肿瘤细胞,不依赖于机体免疫反应,因此对于免疫功能受损的患者也具有潜在的治疗价值。此外,3C-LNPs 的广谱性抗肿瘤活性使其在多种实体瘤,尤其是难治性肿瘤的治疗中展现出巨大的潜力。
清华大学与军事医学研究院联合培养的博士生杨晓童为第一作者,军事医学研究院钟武研究员、李松研究员、曹瑞源副研究员为共同通讯作者。未来,研究团队将继续探索该疗法在临床应用中的潜力,为癌症患者带来更多的希望。

长按扫码可关注
内容中包含的图片若涉及版权问题,请及时与我们联系删除




评论
沙发等你来抢