DRUGAI
深度学习已推动静态蛋白质结构的设计,但天然信号蛋白特有的受控构象变化仍难以实现从头设计。研究人员提出一种通用的深度学习引导方法,可在原子精度下设计蛋白质结构域内的动态构象变化,模拟自然界常见的开关机制。通过解析四种结构,验证了设计构象的准确性,并展示了正位配体和变构突变对构象空间的调控作用。同时,基于物理的模拟结果与深度学习预测及实验数据一致。该方法表明,蛋白质的新型运动模式可通过从头设计实现,为构建具可调控信号行为的仿生蛋白提供了新框架。

天然蛋白质常常具备多个构象状态,其间的受控转换是生物功能实现和调控的关键。例如,激酶活性调控、G蛋白偶联受体(GPCR)信号传导等过程,依赖于蛋白在局部结构域内的细微重排。构象变化的调节因素包括配体结合、环境变化、翻译后修饰、变构效应以及点突变等。这些调节通常并不依赖整体结构的剧烈变化,而是通过结构域内的二级结构元素(如螺旋、环等)发生微小旋转、滑移或倾斜来完成。
尽管上述构象动态对蛋白功能至关重要,但目前从头设计具有类似动态行为的蛋白质仍面临重大挑战。主要困难包括:
能量函数精度不足:现有基于物理的能量函数难以准确区分多个目标构象之间的细微能量差,尤其是在结构域内部的小尺度变化中;
设计空间难以导航:传统多态设计难以高效识别出一个序列能稳定多种构象,特别是这些构象本身也是从头构建的;
设计范例稀缺:目前的研究主要集中在可折叠开关、螺旋缠绕体等较为简单的动力系统,大多数天然蛋白中精细的构象切换机制仍未能复现。
设计策略:构建可调节的双稳态蛋白
为了突破上述限制,研究人员开发了一种通用的深度学习引导策略,可从头设计具备局部构象切换能力的蛋白质,模拟天然信号蛋白中的“构象开关”机制。设计目标是构建一种蛋白序列,在结构空间中存在两个稳定能量极小状态(即双稳态),其分布可通过正位配体或变构突变实现调控。
该方法包括以下三个阶段:
构象生成与筛选:系统性采样产生一组主链构象候选(状态2),并评估其是否具备“可设计性”;
深度学习辅助的多态序列设计:借助AlphaFold2和ProteinMPNN等工具,在关键残基位点执行兼容多个构象的序列设计;
调控因子识别与验证:通过深度学习预测、分子动力学模拟与实验验证,识别出可调节构象偏好的变构位点或配体结合位点。
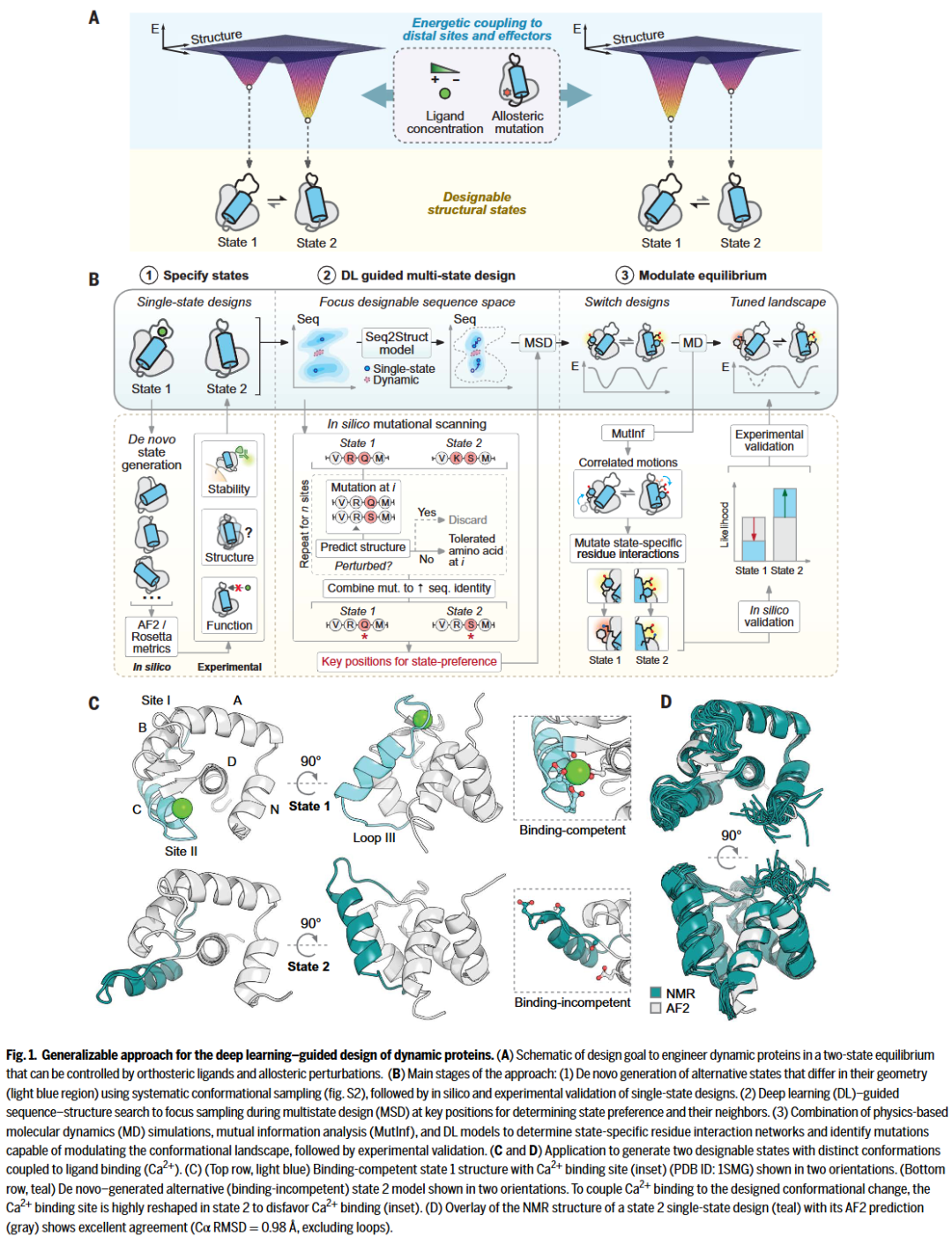
从静态结构出发的动态构象重塑
研究人员选择了一个已知的Ca²⁺结合蛋白作为初始状态(状态1),该蛋白具有两个EF-hand Ca²⁺结合位点。通过引入E41A突变削弱一个结合位点的亲和力,同时确保构象在结合Ca²⁺时基本不变,从而构建了一个“静态但可结合”的蛋白结构作为起点。
接下来,研究人员设计了新的构象状态(状态2),其改变集中于结构域中的一个连续片段,包括loop III、helix C 和 Ca²⁺结合位点II。利用LUCS算法进行loop-helix-loop片段的组合采样,并用Rosetta对每种构象设计适配序列,得到~1000个结构多样、RMSD平均为7.1 Å的候选模型。
通过酵母表面展示实验,选出其中表现良好的设计(#6306),并用NMR解析其三维结构。结果显示该设计在构象和功能上与状态1明显不同,尤其是在Ca²⁺结合位点发生显著重排,丧失结合能力,确认其适合作为不结合状态的代表(状态2)。
深度学习引导的构象兼容序列构建
研究人员希望进一步找到一种序列,能在不改变整体骨架的情况下同时稳定状态1和状态2,即完成“多态设计”。他们采用AlphaFold2预测突变对结构状态的偏好,并锁定了一个关键变构位点——残基89。
通过对设计#6306进行“向状态1靠近”的突变筛选,最终得到一组只在第89位残基差异的序列。这些序列被预测分别偏向状态1(如I89)、状态2(如S89),或呈现混合状态(如R89),成为研究蛋白动态切换的理想模型。
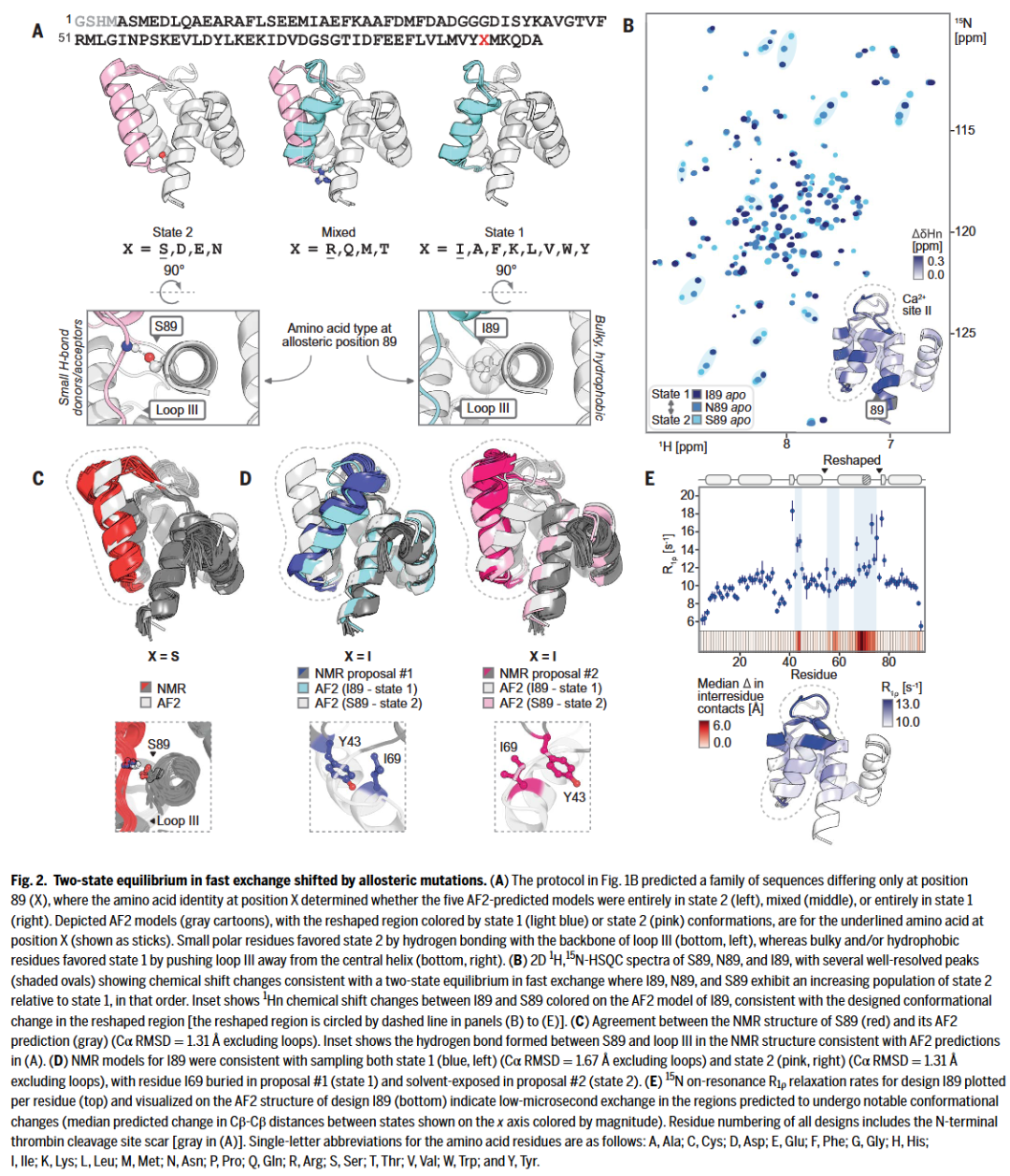
变构调节机制解析:突变如何影响全局构象
选定S89、I89等代表性序列进行NMR测试。结果显示,这些蛋白即便仅在第89位有一个点突变,其整体NMR光谱已出现大幅变化,尤其在远离突变位点的Ca²⁺结合区也有显著的化学位移变化。
研究人员解析了S89和I89的NMR结构,发现S89稳定地处于状态2,而I89表现为两种构象间的快速交换。弛豫色散实验进一步证实该区域的动态变化发生在低微秒级别,并与温度有关。
正位调节机制:配体如何改变构象平衡
为了测试配体(Ca²⁺)是否也可调节构象平衡,研究人员对上述序列进行了Ca²⁺结合实验。结果显示,Ca²⁺结合引发了Ca²⁺位点及周边区域的大范围化学位移变化,结合亲和力与状态1比例呈正相关。
在有Ca²⁺条件下解析的I89结构与状态1高度一致,但仍存在部分状态2特征,说明即使在结合状态下仍存在动态分布。

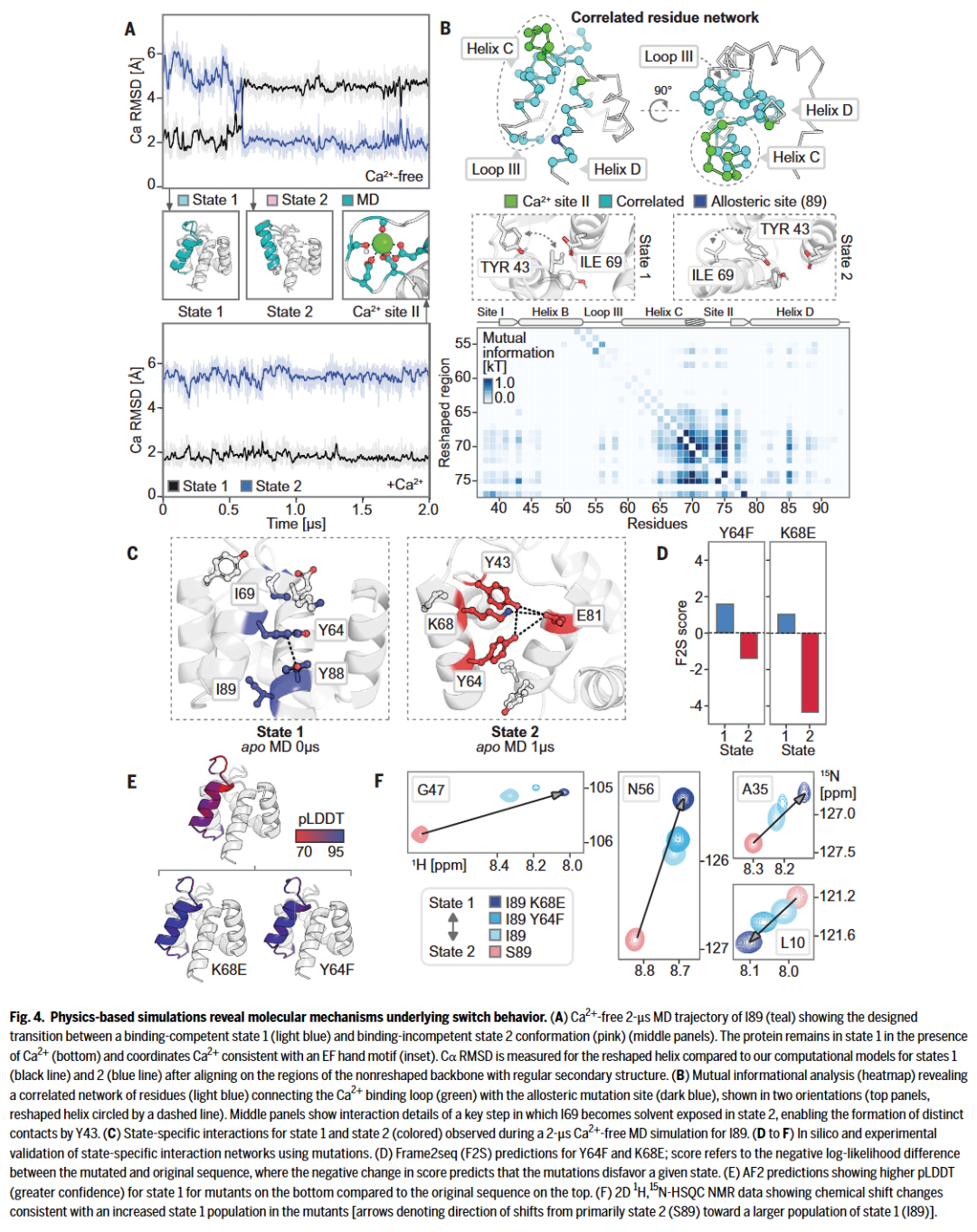
分子模拟支持:揭示动态切换的原子级基础
研究人员对I89和S89进行MD模拟,观察其在有无Ca²⁺条件下的构象变化。结果显示,I89在无Ca²⁺时能在状态1与状态2之间自发切换,符合实验与预测。而有Ca²⁺时则稳定维持在状态1,进一步支持Ca²⁺作为构象调节因子的作用。
通过互信息分析,研究人员发现突变位点89与Ca²⁺结合位点之间存在一条相互作用网络,构成动态调节的物理基础。
最后,研究人员测试了几种基于互信息网络预测的突变(如Y64F、K68E),并通过语言模型打分、AlphaFold2预测和NMR谱图验证其确实可改变构象偏好,进一步确认了调节网络的可设计性和功能性。
讨论
本研究展示了一种通用策略,能够从头设计具备两个明确构象状态的蛋白质,并使其构象间的切换同时受到正位配体(如配体浓度)和远端突变(变构调节)的调控。与以往主要依赖结构域替换或铰链运动的从头设计方法不同,该策略允许设计原子级相互作用网络的重构,使蛋白在不同构象间实现互换,模拟天然调控蛋白超家族(如激酶和GPCR)中的运动模式,显著扩展了可实现的功能空间。
一个显著的发现是:深度学习预测、实验数据和物理模拟之间高度一致。这种一致性不仅提供了可验证的分子机制假设,也使研究人员能够在原子层面上调节构象平衡。这种成果部分得益于设计策略中的关键环节:在序列与结构空间中高效搜索,精准锁定那些对构象切换至关重要的设计位点(如图1B所示)。基于深度学习的蛋白序列设计与结构预测的速度和推理能力,使研究人员能够构建出在不同构象状态中各自稳定的残基互作网络,这对于推进从头设计中的变构调控具有重要意义。
此外,本研究所展示的深度学习与物理模拟的协同作用,为今后开发具预测性构象调控与动态时间尺度控制的设计方法提供了参考。尽管当前的方法尚未显式考虑过渡态势垒,未来有望通过以下方向拓展:
基于模拟数据或实验数据训练模型,从而更快、更精确地预测蛋白的构象集合;
利用机器学习辅助构建新型力场,使能量景观估计更高效且资源需求更低;
融合深度学习与动态实验数据,实现“一次预测、全景呈现”的构象分布预测;
构建能直接生成用户定义的多态构象体系的设计框架。
令人鼓舞的是,即使现有深度学习模型从未专门训练过用于“多构象可逆设计”任务,研究人员仍成功设计出了在不同构象之间展现精细互作网络变化的蛋白质。
值得注意的是,天然蛋白中的功能性构象变化通常十分复杂,难以直接解析和工程化改造。相比之下,研究人员的方法不仅成功构建出与天然机制相似的“双态构象变化”,还准确预测并实现了构象平衡的调控。这一验证性案例表明,该方法不仅适用于将新构象嵌入天然蛋白中,从而调控其天然功能,还可能广泛应用于构建完全生物正交的蛋白质“开关”系统,即不干扰自然系统的新型构象调节元件。
综上所述,本研究的策略与理念为从零开始构建类天然信号系统,或用于解构和重建生物调控机制提供了全新的方向与工具,具有广泛的基础研究和工程应用前景。
整理 | WJM
参考资料
Amy B. Guo et al. ,Deep learning–guided design of dynamic proteins.Science388,eadr7094(2025).DOI:10.1126/science.adr7094
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢