大家好,今天为大家分享一篇最近发表在Nature Chemistry上的文章,题目为Macrocyclic β-arch peptides that mimic the structure and function of disease-associated tau folds。这篇文章的通讯作者是美国圣母大学的Juan R. Del Valle。
Tau病(如阿尔茨海默症、进行性核上性麻痹等)以脑内tau蛋白异常聚集为特征。错误折叠的tau蛋白通过“朊病毒样”传播机制诱导正常可溶性tau蛋白纤维化,但不同疾病中tau蛋白原纤维的交叉β淀粉样结构(cross-β amyloid)存在差异,其构象如何影响种子活性尚不明确。现有研究集中于解析患者来源tau蛋白的结构,但缺乏可模拟病理折叠的小分子工具,阻碍了疾病模型的建立和药物开发。本文作者设计了一类能够模拟tau蛋白病理核心结构的微型多肽(mini-tau),验证其诱导内源性tau蛋白聚集的活性,并解析其构象与疾病相关折叠的相似性。

图1. 基于病理tau蛋白结构的mini-tau设计
在本研究中,作者基于AGD(嗜银颗粒病)、CBD(皮质基底节变性)等4R tau病的冷冻电镜结构,选取包含β-arch基序(如H299-S305、K294-D314等极性相互作用)的核心区域,并将关键的相互作用残基替换为半胱氨酸,再通过双溴化物交联(如间二甲苯、吡啶连接基)形成刚性大环结构。(图1)

图2. mini-tau大环的合成及聚集行为表征
作者使用传统固相多肽合成方法合成了4种(DK、HS、KD、HY)mini-tau序列,并使用5种不同的双溴化物实现mini-tau半胱氨酸侧链交联,共构建了20种mini-tau大环,接着用分析型HPLC表征纯度,高分辨质谱确认分子量。作者使用硫磺素T(ThT)荧光法检测了纯化后的mini-tau大环在生理条件下的聚集行为,实验结果显示有17种mini-tau大环在孵育24h后表现出了显著的聚集。(图2)

图3. 在工程化细胞中验证mini-tau大环的种子活性
接下来,作者在细胞层面探究了mini-tau大环的种子活性。作者使用脂质体转染的方式将20种mini-tau大环“种子”递送进表达突变tau(P301L/V337M)-YFP融合蛋白的HEK293细胞内,如果mini-tau大环可发挥种子活性,则细胞内将会出现荧光聚集斑。结果发现KD-mxyl和KD-pyr(5 μM)染诱导荧光聚集效果最为显著,且其种子活性与环化方式、多肽序列和连接子结构均相关。(图3)

图4. mini-tau大环向β-arch结构的构象转变
作者进一步使用X射线纤维衍射及冷冻电镜表征了mini-tau大环纤维的结构,X射线纤维衍射显示KD-mxyl与KD-pyr纤维均具有4.8 Å(β链间距)和11.0 Å(层间距离)特征峰,证实纤维中存在平行β折叠。圆二色光谱结果显示未纤维化的mini-tau单体为无规卷曲构象,KD-mxyl纤维化后呈现β折叠构象,KD-pyr纤维化后则呈现更为复杂的构象转变。(图4)
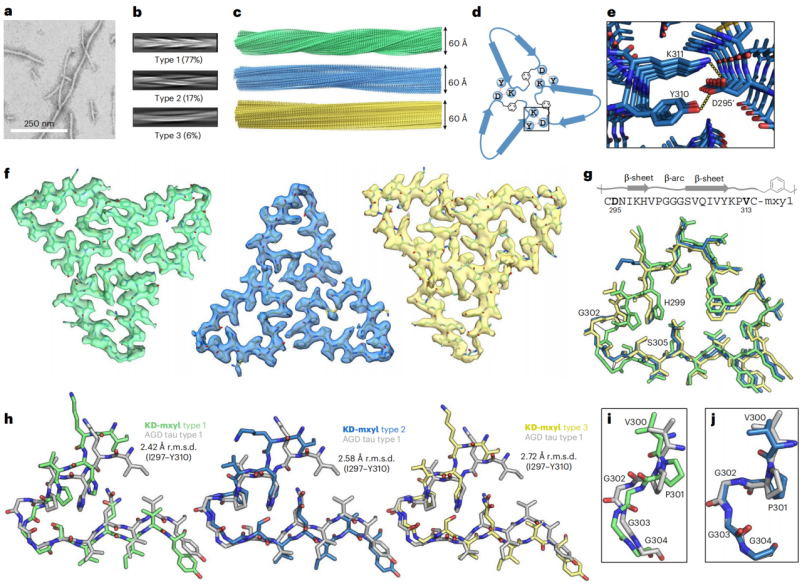
图5. KD-mxyl的冷冻电镜结构
冷冻电镜结果显示,KD-mxyl可以形成三种纤维,其核心β-arch(I297-Y310)与AGD/CBD患者tau的构象高度一致,关键氢键和侧链相互作用也得以保留(图5)。作者在文中还解释了mini-tau的环化必要性,刚性连接基团的影响以及多态性组装的潜在意义。

图6. KD-mxyl诱导原代神经元中野生型人tau蛋白聚集
最后,作者使用KD-mxyl及对照组孵育表达野生型人tau蛋白的小鼠体内分离出的海马体神经元,5天后使用免疫荧光法分析神经元细胞内tau蛋白含量,证实了KD-mxyl播种野生型人tau蛋白的种子活性。(图6)
综上所述,本研究通过大环化将长链tau片段(~30个残基)缩小至14残基,且成功保留种子活性,为研究tau蛋白传播机制提供最小化模型,未来有望作为疫苗表位或抗体开发平台,靶向病理特异性tau构象,为建立体外tau病模型提供工具。
作者:SYM 审校:ZHR
DOI: 10.1038/s41557-025-01805-z
Link: https://doi.org/10.1038/s41557-025-01805-z
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢