DRUGAI
免疫检查点抑制剂为肿瘤治疗带来范式变革,使得多种恶性肿瘤患者获益。然而,接受免疫检查点抑制剂治疗的患者中仅有10%-35%可以获得显著持久的治疗效果,亟需创新治疗策略。
近期,英矽智能在Nature Communications发表研究成果,在人工智能驱动的靶点发现PandaOmics和生成化学平台Chemistry42帮助下,设计了一种新型ENPP1小分子抑制剂,并在临床前模型中验证其可更有效、更安全的调节cGAS-STING通路,从而提供了一种具有前景的免疫疗法创新策略。
值得一提的是,自2025年以来,这已是英矽智能第三篇以AI驱动药物研发实践为主题、发表在Nature子刊的研究成果,也是基于英矽智能AI驱动新药发现管线发表的第四篇Nature子刊论文。
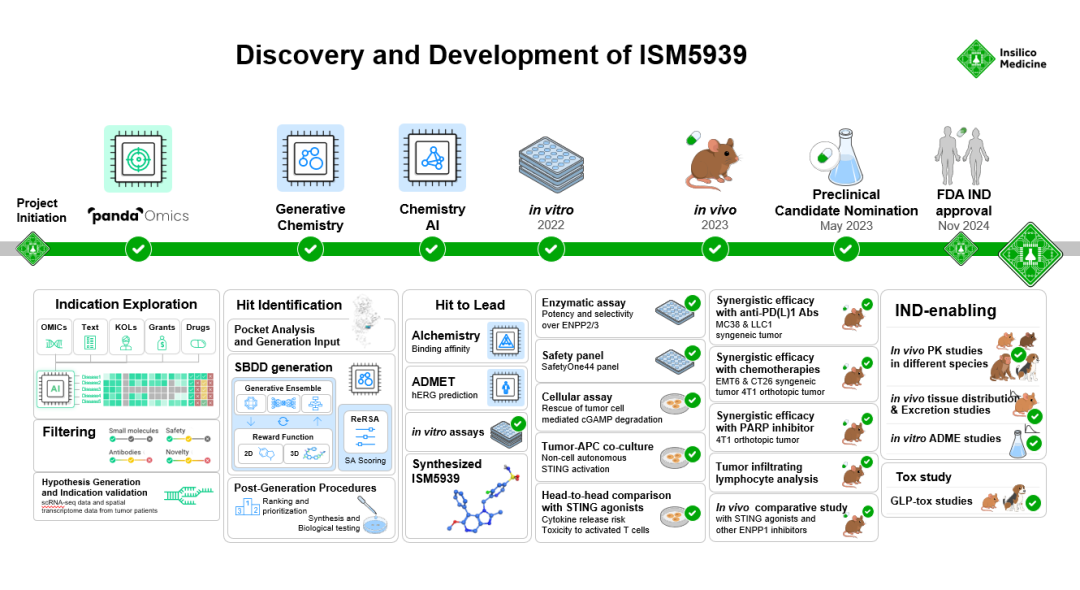
图 1.新型ENPP1抑制剂ISM5939的研发时间线
重新审视cGAS-STING通路
自2013年被明确以来,cGAS-STING通路一直被认为是免疫治疗领域极具前景的靶点。从已知机制来看,当细胞质中的DNA被cGAS识别后,cGAS催化生成第二信使——环状GMP-AMP(cGAMP),cGAMP与STING结合后激活下游信号通路,最终诱导I型干扰素及促炎因子的释放,从而启动先天免疫反应。
研究表明,cGAS-STING通路不仅是连接天然免疫与适应性免疫的关键桥梁,其激活还可诱导细胞凋亡和细胞周期停滞,抑制早期肿瘤的发生发展。同时,该通路促进抗原提呈细胞(APCs)的活化及促炎性细胞因子的产生,进一步推动肿瘤免疫循环、重塑肿瘤免疫微环境。此外,cGAS-STING通路还能促进树突状细胞、T淋巴细胞和自然杀伤细胞(NK细胞)等多种免疫细胞的招募与激活,从而增强机体的免疫监视,提高免疫系统对肿瘤细胞的杀伤能力。
然而,尽管激活cGAS-STING通路在肿瘤免疫治疗中展现出广阔前景,但将其生物学机制转化为安全有效的治疗手段仍面临巨大挑战。此前研究显示,直接靶向STING的激动剂在药代动力学和安全性方面表现不尽如人意,常常会引发全身性细胞因子风暴、降低内源性适应性免疫反应,或难以产生持久疗效,从而限制了其临床应用。那么,有没有更安全方法来精准调控肿瘤中的 STING通路,从而实现有效且可控的抗肿瘤免疫?
寻找更安全的突破口
为解决这一难题,英矽智能选择以靶向ENPP1作为突破口。ENPP1是一种外核苷酸焦磷酸酶,在心血管、神经、免疫、骨骼肌、激素及血液等多种生命活动调节中发挥重要作用。大量研究表明,ENPP1高表达与肿瘤转移、免疫逃逸及多种癌症的不良预后密切相关。
已有研究发现,ENPP1抑制剂可以通过调节胞外cGAMP的浓度激活cGAS-STING通路。研究团队推测,通过抑制ENPP1,从而阻断cGAMP的降解,可增加肿瘤组织内cGAMP的积累,为激活cGAS-STING通路、增强宿主抗肿瘤免疫效应提供一种有前景的策略。
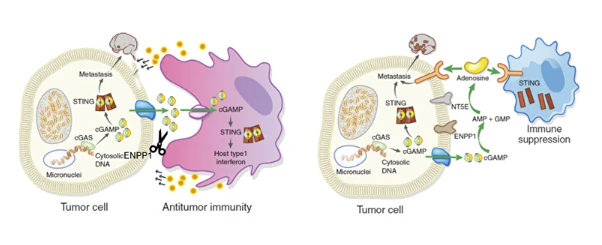
图 2. ENPP1抑制能够实现双重目标:一方面降低免疫抑制分子腺苷在细胞外的水平,另一方面同时提升免疫刺激性分子、STING通路激活因子cGAMP的细胞外浓度。PNAS (2023) 120 (52) e2313693120 ; Cancer Discov (2021) 11 (5): 1212–1227.
与直接靶向STING的激动剂不同,ENPP1抑制剂通过提升肿瘤微环境中胞外cGAMP的浓度,实现对STING通路的局部、原位激活,降低了全身应用STING激动剂可能引起的广泛炎症反应及相关毒性,具有更高的安全性。同时,ENPP1抑制剂可“保留”胞外cGAMP,使其被肿瘤微环境中的抗原提呈细胞(APCs)精准摄取,从而优先激活肿瘤相关APCs,提高I型干扰素等抗肿瘤信号的产生效率,实现更精准的免疫靶向。此外,部分肿瘤对外源性STING激动剂敏感性较低,而ENPP1在多种实体瘤中通常高表达,因此通过ENPP1抑制剂有望实现更广谱的免疫增强和抗肿瘤效果。
AI赋能的靶点探索和分子设计
研究的第一步是确定ENPP1高表达相关的肿瘤类型。英矽智能团队基于AI驱动的靶点发现平台PandaOmics,结合癌症基因组图谱(TCGA)等数据库,对与ENPP1失调相关的适应症进行了系统性识别和排序。结果显示,三阴性乳腺癌(TNBC)、肝细胞癌(HCC)、急性髓性白血病、卵巢癌、结直肠腺癌、乳腺癌、头颈癌和ER阴性乳腺癌等多种癌症,均出现了ENPP1的明显高表达。
同时,团队结合单细胞测序和空间转录组学研究,进一步验证了ENPP1高表达与免疫抑制型肿瘤微环境的密切相关性。生物信息学分析还显示,将ENPP1抑制剂与免疫检查点抑制剂,以及具有DNA损伤作用的化疗药物联合使用,是值得探索的潜在治疗策略。
在确定ENPP1具有广阔免疫调节靶点前景后,团队面临的下一个挑战是如何通过药物实现对其的有效抑制。尽管此前已有报道指出ENPP1抑制剂在选择性和药代动力学(PK)等方面存在挑战,但这些前期研究为团队利用人工智能辅助生成更优分子的尝试奠定了重要基础。
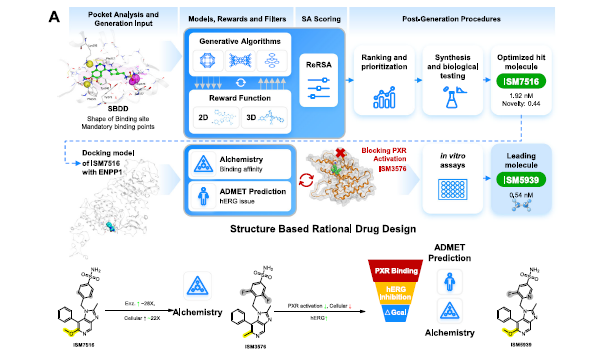
图 3.研究团队利用生成化学平台Chemistry42经过分子生成和优化设计出了 ISM5939
依托结合深度生成模型与强化学习算法的生成化学平台Chemistry42,研究团队以已知ENPP1抑制剂的结构为参考,针对特定靶点结合口袋生成大量新颖的化学结构,并基于多参数优化体系逐一筛选和评估。该流程不仅关注分子的结合亲和力,还综合考量合成可及性、新颖性、ADMET特性及潜在脱靶效应。借助AI驱动的分子设计策略,团队仅用三个月时间便迅速锁定了首批苗头化合物,其中一款化合物IC₅₀达到2.55 nM,较已知抑制剂(IC₅₀=142 nM)效力提升超过50倍。
在进一步的分子优化阶段,团队进一步结合Chemistry42旗下的结合能计算模块Alchemistry及ADMET特性预测模块等多项功能,优先筛选结合自由能更低、hERG毒性较小、ENPP1抑制能力更强的候选分子。经过多轮优化和迭代,最终筛选出成药性优异的候选化合物ISM5939,展现出理想的ENPP1抑制选择性和高效力。
更安全有效的候选分子ISM5939
临床前研究显示,ISM5939具有极高的ENPP1抑制活性以及优秀的成药性,包括理想的ADMET性质和各临床前动物种属的药代动力学和GLP安全性性质。不同于许多传统抑制剂在生理pH条件下活性不足或选择性较低的情况。ISM5939在模拟肿瘤的酸性微环境下依然保持高效力,并对ENPP1表现出极高的特异性,优于ENPP2、ENPP3等相关同源酶。ISM5939在体外和体内的小鼠及人源肿瘤模型中均展现出强效的ENPP1抑制活性,在乳腺癌、肾癌、结直肠癌、黑色素瘤和肺癌等多种癌症模型中表现出低纳摩级别的IC₅₀,并能够增强肿瘤分泌cGAMP的积累。
在体内药效模型中,ISM5939在与多种疗法联用时表现出良好的疗效,有望通过调节免疫反应和提高治疗效果,增强现有癌症治疗的效果。当与抗PD-1疗法结合使用时,ISM5939可以协同增强T细胞活性并提升抗肿瘤免疫力。而与化疗结合时,ISM5939增加了肿瘤微环境中的cGAMP累积,从而激活抗原呈递细胞(APC)中的STING通路,改善化疗效果。同样,与PARP抑制剂联合使用时,ISM5939进一步强化了STING的激活,驱动更强的抗肿瘤免疫反应。
此外,与直接STING激动剂相比,ISM5939的安全性更佳,未显著诱发外周血中的促炎症细胞因子产生,也未触发肿瘤微环境内效应T细胞死亡,因此其安全窗大大提高。
转化医学方面,我们已启动筛选能够预测ISM5939反应的生物标志物,例如cGAMP转运体LRRC8A。研究发现,在LRRC8A高表达的肿瘤样本中,PD-1/PD-L1耐药的肿瘤往往表现出ENPP1的高表达,这提示LRRC8A和ENPP1的共同高表达能够预测哪些患者有望通过联合免疫疗法克服耐药。同样,ENPP1在对化疗耐药的患者肿瘤中表达也更高,而cGAS低/ENPP1低的癌症模型对ISM5939的反应性较差,这进一步表明ENPP1及cGAS-STING通路相关基因可能成为ISM5939应答的生物标志物,并有望为今后ENPP1抑制剂治疗实体瘤的患者筛选提供指导。
英矽智能于2023年5月将ISM5939提名为针对ENPP1的免疫治疗候选研发药物,并于2024年11月获得美国FDA的临床试验许可。公司期待与行业伙伴达成合作,加速其进一步临床转化。
重塑创新药物研发路径
本项研究通过将生物学、计算科学与AI驱动的药物发现和设计深度结合,为肿瘤免疫治疗提供了全新的可能性。研究团队期待ISM5939的研发过程能够为业界带来启发,并推动新一代创新药物的发现,进一步释放STING靶向疗法的潜力。
此前,英矽智能曾于2024年3月和11月在《自然-生物技术》(Nature Biotechnology)分别发表了靶向TNIK用于特发性肺纤维化的小分子抑制剂研究,及靶向PHD1/2用于炎症性肠病的小分子抑制剂研究。2025年1月,英矽智能与加拿大多伦多大学合作,在《自然-生物技术》发表了基于量子-经典混合模型设计新型KRAS抑制剂的研究。同年5月,又与广州医科大学赵金存课题组等合作,在《自然-通讯》发表了AI赋能广谱冠状病毒抑制剂设计的研究成果。
通过整合先进的AI和自动化技术,英矽智能在实际应用案例中展现出效率提升,为AI驱动的药物研发树立了标杆。与传统药物研发通常需要2.5-4年的时间周期相比,英矽智能在2021至2024年间提名的22个款候选药物,从立项到提名临床前候选药物(PCC)的平均耗时为12-18个月之间,每个项目仅需合成和测试约60-200 个分子,从 PCC到 IND-enabling阶段的成功率达到 100%。
参考资料
[1]Pu, C., Cui, H., Yu, H. et al. Oral ENPP1 inhibitor designed using generative AI as next generation STING modulator for solid tumors. Nat Commun 16, 4793 (2025).
https://doi.org/10.1038/s41467-025-59874-0
内容中包含的图片若涉及版权问题,请及时与我们联系删除




评论
沙发等你来抢