摘要
本文强调衰老机制中的因果关系,认为在衰老的十二个标志中,只有端粒缩短是导致衰老的原因。“端粒DNA和核糖体DNA共同调控细胞衰老模型”表明,端粒和rDNA阵列的缩短可以通过P53通路介导各种衰老标志。因此,逆转衰老和显著延长寿命的最佳途径是增加组织内成体干细胞端粒和rDNA阵列的长度。
关键词:衰老标志(Aging Hallmarks)、因果关系(Causality)、端粒(Telomere)、核糖体DNA(rDNA)、P53通路、程序化衰老


论文题目:Causality of Aging Hallmarks
论文链接:https://www.aginganddisease.org/EN/10.14336/AD.2025.0541
发表时间:2025年5月20日
论文来源:Aging and Disease
程序化衰老的本质:从非洲鳉鱼到基因时钟
程序化衰老的本质:从非洲鳉鱼到基因时钟
衰老是否由随机损伤积累所致?研究通过非洲鳉鱼(Nothobranchius)的跨地域对比给出否定答案:津巴布韦、莫桑比克、坦桑尼亚三种鳉鱼在相同饲养条件下,寿命仍分别保持3个月、9个月、16个月,与其栖息地雨季时长精确对应。这种“与生俱来”的寿命差异提示,衰老本质上是DNA层面的遗传程序。
程序化衰老的核心在于基因表达的时序切换。以肝细胞为例,在胚胎期表达甲胎蛋白(AFP),成年后转为白蛋白(Albumin),老年期则出现功能紊乱蛋白。这种模式切换由端粒与rDNA组成的“分子时钟”驱动——两者均为多拷贝串联重复序列,在细胞分裂中不可逆缩短,通过激活P53信号形成浓度梯度,逐步改写基因表达谱(图1)。
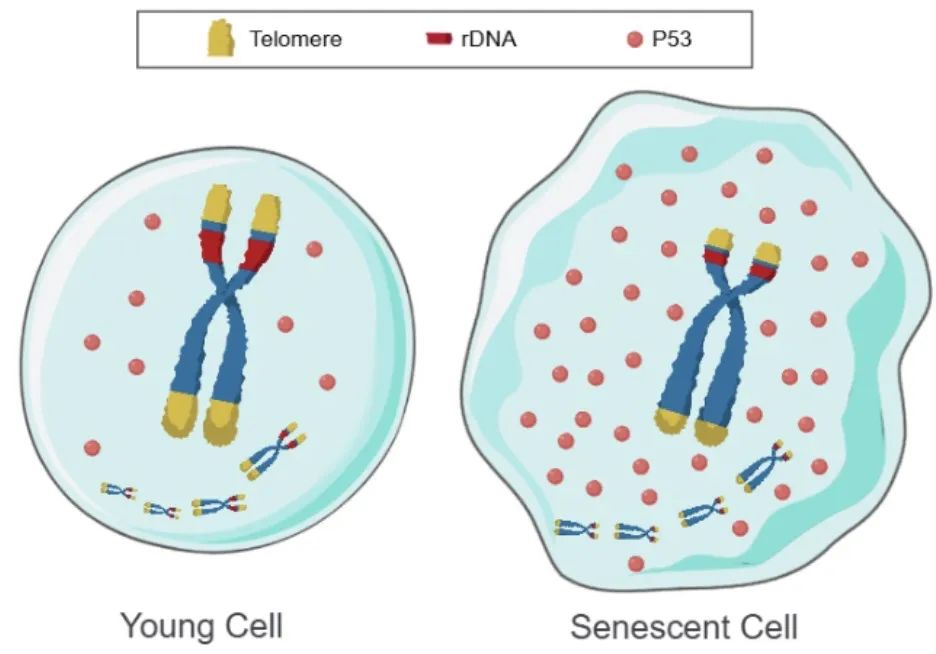
图 1. 细胞衰老的端粒DNA和核糖体DNA共调控模型。
左:端粒和rDNA长排列的染色体:P53迅速降解,P53水平低,细胞年轻。右:端粒和rDNA短排列的染色体:P53缓慢降解,P53水平高,细胞老化。
细胞衰老的调控枢纽:端粒与rDNA的共同作用
细胞衰老的调控枢纽:端粒与rDNA的共同作用
传统观点认为端粒缩短通过触发DNA损伤导致衰老,但矛盾显而易见:小鼠初始端粒长度(50kb)远超人类(15kb),却寿命更短;果蝇端粒甚至不缩短却能衰老。研究团队提出“端粒-rDNA共调控模型”:
1. 双时钟机制:端粒位于染色体末端,rDNA集中于近端着丝粒染色体短臂,两者均通过转录损耗长度,且缩短速率同步(约每年6420bp)。
2. P53的中介作用:年轻细胞中长端粒/rDNA可快速降解P53,保持低水平;随着缩短,P53累积并抑制组蛋白乙酰化,导致染色质凝聚、转录效率下降。敲低小鼠干细胞中45S rDNA拷贝数,P53/P21/P16等衰老标志显著上调,细胞分裂能力骤降。
3. 非分裂细胞的衰老密钥:在终末分化细胞中,rDNA单独承担“计时”功能。果蝇40天寿命内rDNA拷贝数减半,其串联重复结构设计恰似为衰老“量身定制”。
破解衰老标志的因果链
破解衰老标志的因果链
研究通过P53信号网络,将十二大衰老标志归因于端粒/rDNA缩短的次级效应:
1. 基因组不稳定(Genomic Instability)
传统理论认为端粒过短引发染色体融合,但老年细胞中残留端粒仍远超安全阈值。真相在于:P53抑制组蛋白去乙酰化酶(HDAC)和DNA甲基转移酶(DNMT1),导致异染色质区稳定性丧失。例如,敲除rDNA的小鼠造血干细胞中,着丝粒蛋白CENP-A表达下调,染色体分离错误率激增。
2. 线粒体功能障碍(Mitochondrial Dysfunction)
P53通过抑制SIRT1-PGC1α轴,关闭线粒体生物合成。实验显示,端粒延长的小鼠线粒体DNA损伤减少50%,而抗氧化剂维生素C虽提升线粒体活性,却因加速“分子时钟”缩短寿命。
3. 慢性炎症(Chronic Inflammation)
衰老细胞释放的mtDNA片段激活cGAS-STING通路,引发“无菌性炎症”。但清除衰老细胞的药物达沙替尼(Dasatinib)反而加速卵巢衰老——炎症是衰老的结果而非原因,关键仍在于逆转干细胞端粒/rDNA损耗。
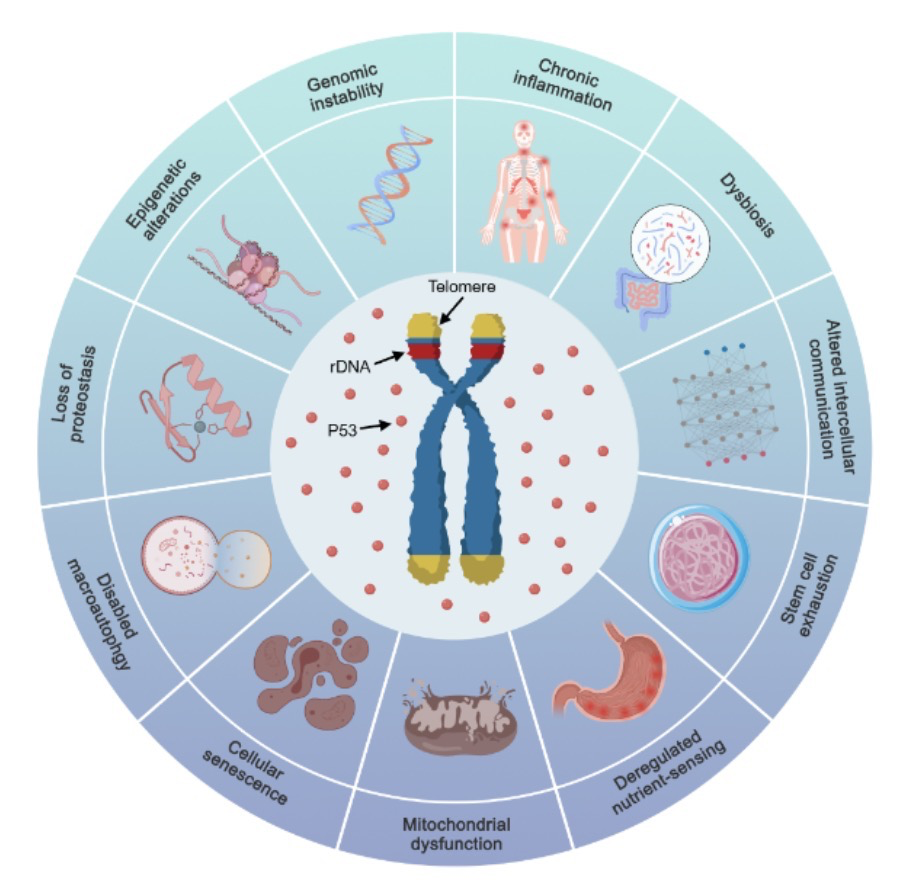
图2. 由端粒和rDNA通过P53介导的衰老的11个主要标志。
抗衰老的未来:重编程“分子沙漏”
抗衰老的未来:重编程“分子沙漏”
当前抗衰老策略多聚焦于表观遗传修饰或清除衰老细胞,但研究表明:
1. 表观遗传时钟的局限性:生长激素可逆转DNA甲基化年龄,却透支端粒储备,加速实际衰老。
2. 干细胞移植的困局:自体干细胞体外扩增引发复制衰老,诱导多能干细胞(iPSC)则面临高突变率。
真正突破在于直接延长组织干细胞中的端粒与rDNA阵列。实验证实,端粒酶激活可使小鼠寿命延长40%,毛色恢复年轻态。未来,针对300余种组织干细胞的“分子沙漏”修复,或将成为逆转衰老的终极答案。
彭晨|编译
生命复杂性读书会:
生命复杂系统的构成原理
在生物学中心法则的起点,基因作为生命复杂系统的遗传信息载体,在生命周期内稳定存在;而位于中心法则末端的蛋白质,其组织构成和时空变化的复杂性呈指数式增长。随着分子生物学数十年来的突飞猛进,尤其是生命组学(基因组学、转录组学、蛋白质组学和代谢组学等的集合)等领域的日新月异,当代生命科学临近爆发的边缘。如此海量的数据如何帮助我们揭示宇宙中最复杂的物质系统——“人体”的构成原理和设计原理?阐释人类发育、衰老和重大疾病的发生机制?
集智俱乐部联合西湖大学理学院及交叉科学中心讲席教授汤雷翰,国家蛋白质科学中心(北京)副研究员常乘、李杨,香港浸会大学助理教授唐乾元,北京大学前沿交叉学科研究院研究员林一瀚,中国科学院分子细胞科学卓越创新中心博士后唐诗婕,共同发起「生命复杂性:生命复杂系统的构成原理」读书会,从微观细胞尺度、介观组织器官尺度到宏观人体尺度,梳理生命科学领域中的重要问题及重要数据,由生物学家提问,希望促进统计物理、机器学习方法研究者和生命科学研究者之间的深度交流,建立跨学科合作关系,激发新的研究思路和合作项目。读书会目前共进行10期,现在报名参与读书会可以加入读书会社群,观看视频回放,解锁完整读书会权限。
推荐阅读
Cell速递:信息论视角下的衰老:表观遗传信息丢失是哺乳动物衰老的原因之一
内容中包含的图片若涉及版权问题,请及时与我们联系删除




评论
沙发等你来抢