

医学
Medicine


2025年7月2日,温州医科大学张康教授团队在Cell Press细胞出版社旗下期刊Cell Reports Medicine发表了一篇论文,题为“AI-enabled molecular phenotyping and prognostic predictions in lung cancer through multimodal clinical information integration”。该研究提出了一个名为LUCID的多模态人工智能框架模型,该模型能够整合CT影像、主诉、实验室检测结果和人口统计学信息,以无创方式预测肺癌患者的EGFR基因突变情况和生存结局。
温州医科大学张康教授,北京大学未来技术学院王劲卓教授,温州医科大学附属第一医院黄晓颖教授、四川大学华西医院王成弟教授为本文共同通讯作者。北京大学未来技术学院陆宇星博士研究生、北京协和医学院刘飞博士、广州实验室余运芳博士、四川大学华西医院陈勃江研究员为共同第一作者。


▲长按图片识别二维码阅读原文
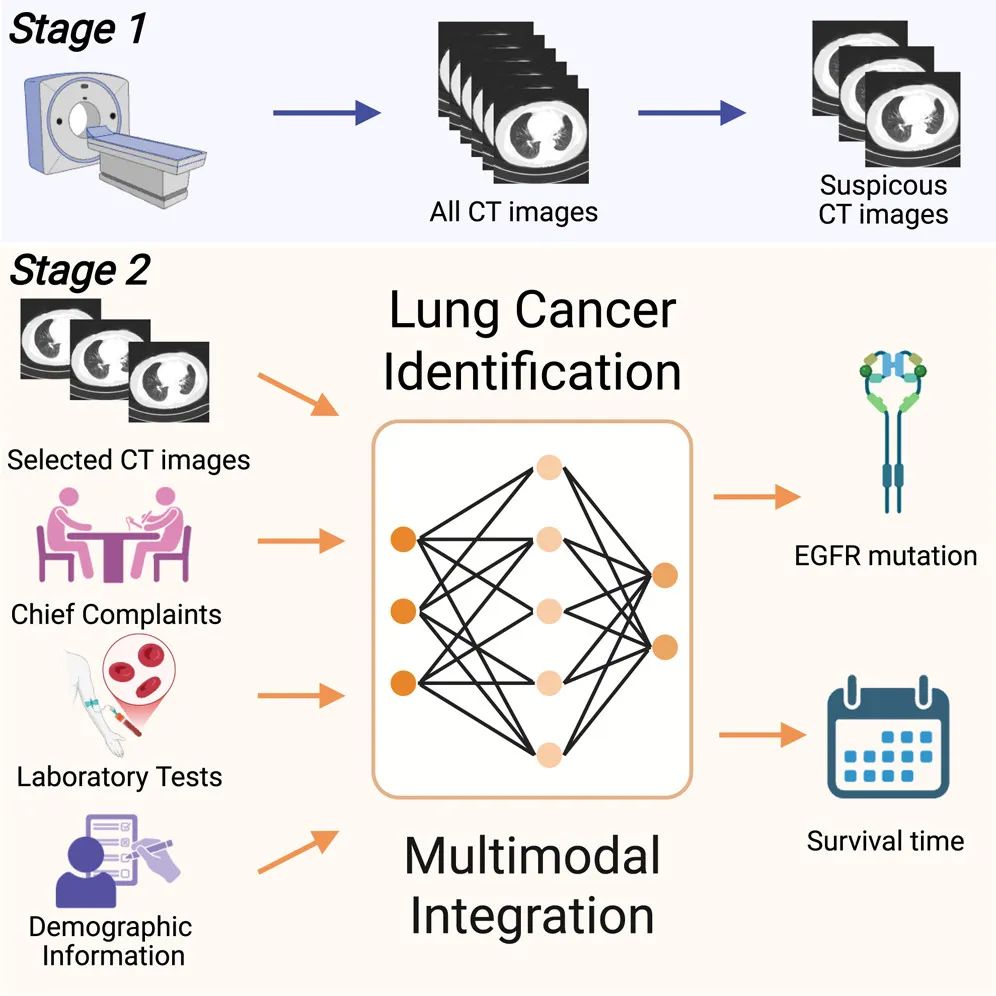
肺癌是全球癌症相关死亡的主要原因,给全球医疗健康带来了巨大挑战。近年来,人工智能(artificial intelligence,AI)的进步为改善肺癌的诊断、治疗规划和预后预测提供了前所未有的机会。特别是在医学影像分析领域,深度学习算法在解读计算机断层扫描(CT)等影像数据方面取得了显著成功,能够识别出人眼难以察觉的细微病变特征,从而实现更早期、更精准的诊断。然而,传统的诊断模型往往只依赖单一类型的数据,限制了其临床评估的全面性。
在非小细胞肺癌的治疗中,表皮生长因子受体(EGFR)基因突变是一个关键的驱动因素,它能促进肿瘤的发生与发展。特定的EGFR突变(如外显子19缺失和L858R突变)是EGFR酪氨酸激酶抑制剂(TKIs)的有效治疗靶点,携带这些突变的患者使用靶向药物通常能获得比传统化疗更好的疗效和更少的副作用。因此,快速、准确地识别EGFR突变状态对于制定个性化治疗方案至关重要。目前,基因突变检测通常依赖于组织活检等侵入性手段,这不仅给患者带来风险和不适,也需要一定的检测时间。因此,开发一种经济、无创的检测方法来预测基因突变和患者的生存期,对于优化治疗决策和改善患者预后具有重大意义。
近日,来自温州医科大学、北京大学、四川大学华西医院和广州国家实验室等机构的研究团队,开发了一种名为LUCID的新型两阶段多模态人工智能框架。该框架通过整合包括CT影像、患者主诉、实验室检查结果和人口统计学信息在内的四种不同类型的临床数据,旨在无创地预测肺癌患者的EGFR基因突变类型和生存结局。研究表明,LUCID模型在一个包含5175名患者的回顾性队列中表现出强大的预测性能,其预测EGFR突变的AUC达到了0.881,预测患者生存时间的AUC高达0.912。此外,该模型在一个包含1285名患者的独立外部验证队列中也展现了优异的泛化能力与稳健性,证实了其在不同数据集上的有效性。该研究不仅展示了多模态数据融合在精准肿瘤学中的巨大潜力,也提供了一个可扩展的工具,有望辅助临床决策,为肺癌患者制定更个性化的治疗方案。研究结果全文在Cell Reports Medicine发表。

作者专访

Cell Press细胞出版社特别邀请本文研究团队
进行了专访,请他们为大家进一步解读。











相关论文信息

论文原文刊载于Cell Press细胞出版社
旗下期刊Cell Reports Medicine,
点击“阅读原文”或扫描下方二维码查看论文

▌论文标题:
AI-enabled molecular phenotyping and prognostic predictions in lung cancer through multimodal clinical information integration
▌论文网址:
https://www.sciencedirect.com/science/article/pii/S2666379125002897
▌DOI:
https://doi.org/10.1016/j.xcrm.2025.102216
▲长按图片识别二维码阅读原文

Cell Reports Medicine现已加入Cell Press MJS多刊审稿!Cell Press Multi-Journal Submission(点击查看)的前身Cell Press Community Review模式于2021年推出。对于通过Cell Press Multi-Journal Submission“多刊审稿”模式投稿的作者,我们将提供稿件被多本期刊同时考虑的机会。超过80%通过Cell Press Multi-Journal Submission“多刊审稿”模式投稿的文章获得了至少一个或多个期刊的评审。
CellPress细胞出版社
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢