DRUGAI
生物大分子在进化过程中形成的互作关系,使得生命系统能够在不同的时间和空间尺度上传导信号和能量。若能有效利用这些广泛互作关系中的模式,将为分子设计和治疗开发带来巨大的机遇。研究人员将这一使命转化为可计算的任务,借助人工智能(AI)和加速计算技术,打造出一个“结构互作组的计算显微镜”。

生物分子之间的相互作用——如蛋白质与小分子的互作——决定了更大层级的生物组织结构,并协调生命过程的基本运行。若想识别这些互作并理解其发生机制,就需要开发出一种“显微镜”,以解码这些三维结构,即分子互作中原子的坐标信息,从而还原分子组分的细节。实验手段如X射线晶体学和冷冻电镜虽极为强大,但往往受到实验周期长、样品制备繁琐等限制。而计算显微镜可以绕过这一瓶颈,直接基于分子身份合成结构图像。
过去半个世纪,这一理念仍属“登月计划”,直到近期AI驱动的蛋白质结构预测取得突破。与传统依赖穷举假设的模拟方法不同,AlphaFold2及相关AI预测工具通过挖掘数百万年分子进化的痕迹和实验结构中的统计规律,成功构建出具备前所未有精度的蛋白质结构推理模型。这些模型依赖进化约束(如多序列比对或蛋白语言模型),并通过专用神经网络解析氨基酸(三维蛋白构件)之间的空间排列。
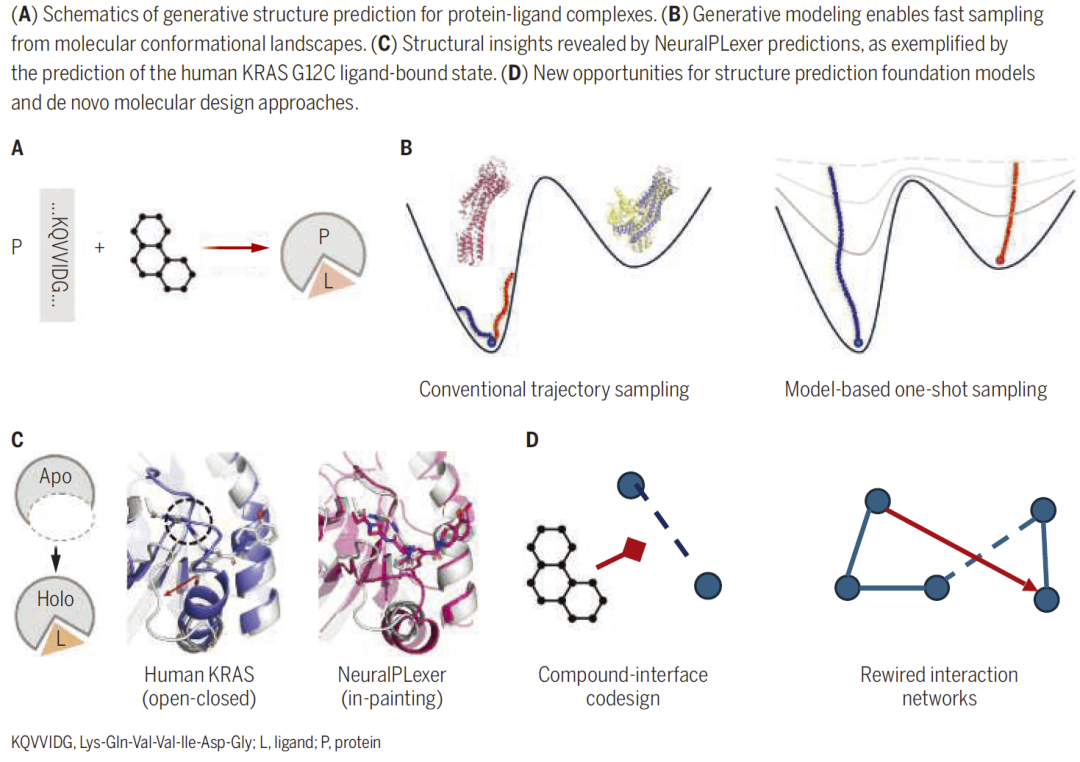
研究人员进一步拓展了这一愿景,通过生成式机器学习方法聚焦于两个关键方面:蛋白质与配体的相互作用,以及其构象景观的建模。
生物分子高度动态化,需要多个快照才能完整捕捉其行为。蛋白质的形状常受到小分子配体和翻译后修饰的调控,这些变化驱动构象转变,调控关键生物功能,并为药物发现提供切入点。传统“锁钥模型”在处理蛋白-配体结合预测时,常假设蛋白质为刚性体,难以应对这种复杂性。尽管分子动力学可模拟结合和构象变化,但其在跨越能垒、采样低能构象态之间的转换方面计算成本高昂。
为解决这一难题,研究人员提出了生成式AI策略——NeuralPLexer。该模型基于扩散生成方法,从整个分子复合体的初始草图出发,逐步细化结构细节,生成一组构象快照,从而涵盖生物分子的热力学构象景观。这种“一次性生成”方式有效跳过了高能采样障碍,快速获取原子级分子互作图景。NeuralPLexer 的神经网络结构模拟了生物大分子的多尺度层级组织:从预测蛋白-配体接触出发,逐步生成几何结构,同时保持物理对称性。
作为初步验证,研究人员利用NeuralPLexer预测了隐性结合口袋的形成——这类结合位点在未结合状态下不存在,而是在配体结合后诱导生成。在一个包含小分子显著改变蛋白构象的数据集中,NeuralPLexer成功生成了与实验一致的构象分布。在多种酶体系中,该模型所采样的构象集合与实验结构表现出高度一致性(如通过结构比对得分衡量),有效突破了静态蛋白质结构模型的局限。此外,通过对构象预测赋予置信评分,NeuralPLexer展现出区分强/弱结合配体的能力,尽管其并未以亲和力为监督信号进行训练。
研究人员还用该方法深入解析蛋白质功能机制。例如,在一种已解析催化机制的酮酸还原异构酶中,模型准确捕捉到了辅因子和抑制剂结合时N端结构域的闭合运动,并提示了靶点的自组装可能性。而在G蛋白偶联受体的研究中,模型提出了在无配体状态下受体仍保持活性的构象假说。上述能力展现了NeuralPLexer在解析变构调控和酶催化机制中的广泛潜力。
除了原子构象层面,研究人员还构建了名为OrbNet-Equi的几何深度学习方法,以研究分子互作的能量变化,其精度可比肩量子力学计算但计算效率提高了约千倍。借助这类工具,研究人员可以更高分辨率地解析质子化状态、电荷/自旋构型等变化,从而更全面地描述质子或电子传递路径。
除了已知蛋白-小分子互作的结构预测外,研究人员还将NeuralPLexer拓展为具备“图像修复式”功能的结构补全模型,用于识别新颖结合位点。类似AI图像编辑工具可根据周围信息补绘选中区域,该方法在仅依赖目标蛋白主链的情况下,同时推断配体结构、蛋白序列与结合口袋的形状变化。在KRAS-G12C等挑战性靶点中,该方法显著优于传统构象搜索和对接算法。
随着结构基础模型预测精度的持续提升,未来研究将进一步扩展其适用范围,包括更复杂的互作模式及多组分装配体的任意计量比结构预测,特别是由化学调节剂稳定化的蛋白-蛋白互作界面(即诱导近邻机制)。这类进展将推动靶向蛋白互作网络的配体理性设计,最终实现细胞状态的恢复。
统一的互作预测模型结合de novo结合剂设计框架,有望成为调节蛋白互作界面的强大平台,进而影响致病蛋白的亚细胞定位及特定组装体的形成。这类“重编细胞信号传导”的方法不仅能提升治疗精度,还能通过靶向寡聚体、避开功能性单体,从而拓宽治疗窗口。这些新兴能力将有助于将结构基础模型发展为推动化学生物学进展和加速药物发现的通用工具。
整理 | WJM
参考资料
Zhuoran Qiao ,AI to rewire life’s interactome: Structural foundation models help to elucidate and reprogram molecular biology.Science389,244-245(2025).DOI:10.1126/science.adx7802
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢