
生命科学
Life science


阿尔茨海默症(Alzheimer’s disease, AD)是一种进行性神经退行性疾病,是最常见的痴呆类型。其发病机制复杂,涉及遗传、表观遗传、炎症及神经免疫等多个方面,已成为全球老龄化背景下亟待应对的重大健康挑战。AD的病理进展表现出显著的脑区特异性:内嗅皮质和海马最早受累,随后扩展至广泛皮层区域,提示不同脑区和细胞类型对病理冲击具有不同的易感性。此外,临床研究发现一部分AD患者即使存在明显的病理负荷,仍能保持相对良好的认知能力,表现出“认知韧性/认知抵抗力”(Cognitive Resilience, CR)。这一现象打破了病理积累与认知衰退之间的线性关系假设,提示存在潜在的保护性调控机制。然而,目前我们对AD进展和认知韧性在不同脑区和细胞类型中表观基因组与转录组协同调控的理解仍不充分。亟待回答的关键科学问题包括:AD进程中表观调控如何在脑区和细胞类型间呈现动态变化?哪些细胞群体最为脆弱?表观不稳定性如何驱动细胞功能退化与耗竭?这些变化如何与神经退行、胶质激活、认知衰退及认知韧性关联?此外,维持脑内表观稳态的关键调控网络也亟待深入解析。
2025年8月1日,来自麻省理工学院计算机科学与人工智能实验室(CSAIL)Manolis Kellis课题组的刘尊鹏博士和张珊珊博士等在Cell Press细胞出版社旗下期刊Cell上发表了题为“Single-cell multiregion epigenomic rewiring in Alzheimer’s disease progression and cognitive resilience”的研究论文。该研究构建了AD跨脑区的单细胞调控图谱,系统解析了AD疾病进展及认知韧性在不同脑区和细胞类型中的表观基因组与转录组动变化。研究全面揭示了AD发展过程中表观稳态失衡所关联的易感脑区、细胞类型、关键基因组区域、遗传风险位点及调控网络。结果表明,表观信息的丢失和表观基因组不稳定性与AD进程中特定细胞类型的功能衰退与耗竭密切相关;相反,表观基因组完整性的维持是认知保护与认知韧性的关键基础。该研究为深入理解AD疾病进展及认知韧性的分子机制提供了全新视角,并为精准干预提供了理论依据与潜在靶点。


▲长按图片识别二维码阅读原文
系统构建阿尔茨海默症跨脑区调控全景
该研究基于来自111位处于不同AD阶段个体的六个脑区样本,构建了覆盖约350万个细胞的单细胞表观基因组与转录组全景,系统描绘了67个高分辨率脑细胞亚型的跨脑区单细胞调控图谱。借助双模态单细胞数据,研究揭示了脑区特异性的分子调控网络,并系统解析了神经退行性疾病和精神类疾病的GWAS风险位点在特定细胞类型及其调控网络中的富集规律。
AD中表观基因组“松弛化”、表观特征丧失与转录精度下降
研究人员在单细胞层面、以100-kb分辨率构建了人脑细胞类型特异的染色质区室图谱,并系统剖析了AD中表观基因组重塑的机制。结果显示,AD进程中各类型细胞普遍表现出表观结构“松弛化”与功能特征的丧失,尤其以内嗅皮质与海马中的神经元和胶质细胞最为显著。具体表现为:靠近核膜的异染色质区域异常激活,而活跃的染色质区域(如启动子与增强子)趋于被抑制。转录组整合分析进一步表明,这些表观基因组紊乱与转录精度下降密切相关,提示表观稳态破坏可能是AD中转录调控紊乱的关键驱动因素。
AD中表观信息崩解驱动细胞退行与耗竭
研究团队构建了“表观信息”(epigenomic information)评分模型,用以量化单细胞表观基因组的完整性。研究发现,AD晚期脑区中表观信息显著丢失,且这些表观信息下降的细胞类型高度重合于在AD中明显减少的细胞类型,提示表观不稳定性可能是细胞功能衰退与死亡的潜在驱动力。在胶质细胞中,该研究描绘了一个从激活到耗竭的状态轨迹:早期激活阶段伴随着表观信息的升高,反映出胶质细胞调控活性的增强;随着病程进展与慢性炎症积累,细胞逐步进入耗竭阶段,表观信息随之崩解并伴随功能衰竭。值得关注的是,AD相关GWAS风险位点显著富集于表观信息水平较高的激活态小胶质细胞和星形胶质细胞中,提示遗传风险可能通过扰动免疫与表观调控网络,推动胶质细胞由防御向功能耗竭演化。
维持表观基因组稳定性是认知功能维持与认知韧性的关键
该研究进一步揭示了“认知韧性”的表观遗传基础。研究发现,相较于AD患者中普遍的表观信息广泛丢失,认知韧性个体的神经元和胶质细胞普遍保持较高的表观信息水平。深入分析表明,表观信息的维持与细胞的存续状态密切相关:在认知韧性个体中,AD高度易感的神经元亚群与激活态胶质细胞不仅拥有更高的表观信息,还呈现出更高的细胞比例,提示在表观稳态维持的背景下,这些关键细胞更可能逃逸病理驱动的退行与耗竭过程,从而支持认知功能的维持。结果表明,表观基因组的稳定性可能构成认知保护与韧性的核心分子机制。
解析表观稳态调控网络与AD临床特征的耦合关系
研究最后系统解析了表观稳态维持与失序的多维调控网络及其临床关联。结果显示,维持表观稳定性的关键基因多富集于核结构、染色质构象、蛋白质定位等基本细胞功能通路,突出核结构在维持细胞功能和表观稳态中的核心作用;而表观不稳定性相关的基因则富集于神经退行、炎症反应和应激反应等相关通路。上游调控因子分析揭示,表观侵蚀相关基因受到多梳复合物、异染色质调控因子及免疫调控因子的调控,提示异染色质屏障破坏可能促使关键抑制基因的异常激活。系统的临床相关性分析显示,较高的表观信息水平显著关联于更好的认知功能、更缓慢的认知退化速率和更强的认知韧性;相反,表观稳定性的下降则与AD临床诊断、全脑病理负担、神经纤维缠结密度及淀粉样蛋白水平密切相关。上述结果进一步强调,表观稳态失衡是驱动AD进展和认知衰退的关键机制,而维持表观稳态可能是实现认知保护和干预AD进程的潜在途径。
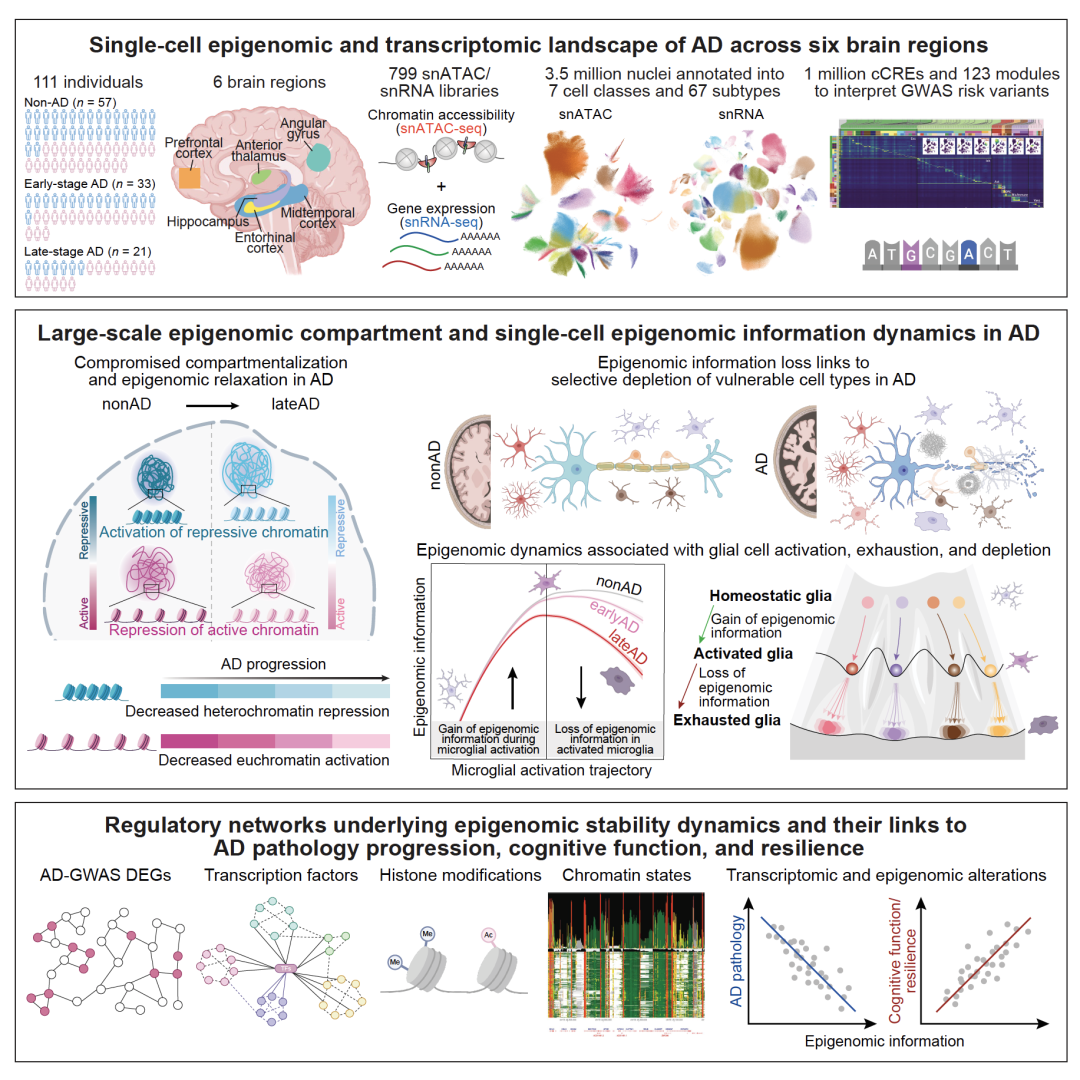
图:跨脑区单细胞多组学揭示阿尔兹海默症进展和认知韧性的表观遗传分子机制
综上所述,该研究基于跨脑区大规模单细胞多组学图谱,揭示了AD进程与认知韧性的表观调控基础。研究发现,表观稳态失衡与细胞退行、耗竭及病理进展密切相关,而维持表观稳定性则有助于认知保护和认知韧性。该研究构建了一个系统性框架,阐明了表观扰动、调控网络崩解与细胞功能退化的关联,识别了关键调控因子和潜在干预通路,为理解AD机制及发展精准治疗策略提供了新视角和理论基础。

作者专访

Cell Press细胞出版社特别邀请论文第一作者兼通讯作者刘尊鹏博士进行了专访,请他为大家做进一步的深入解读。











作者介绍


刘尊鹏
博士
刘尊鹏,2022年博士毕业于中国科学院动物研究所/干细胞与再生医学创新研究院,师从衰老生物学家刘光慧研究员与曲静研究员,主要从事人类衰老的表观遗传调控机制研究。2022年11月,加入麻省理工学院(MIT)计算机科学与人工智能实验室(CSAIL)和Broad研究所(Broad Institute of Harvard and MIT),在MIT计算生物学与人工智能中心主任Manolis Kellis教授团队开展博士后研究,并于2025年3月晋升为研究科学家。其研究方向聚焦于复杂疾病的多层级调控网络及分子机制解析。博士及博士后期间,以第一作者/共同第一作者/共同通讯作者身份在Cell(2023 & 2025)、Developmental Cell、Cell Research、Cell Discovery、Protein & Cell、Nature Communications、Nucleic Acids Research,Cell Reports等杂志共发表论文18篇,H指数35。相关研究成果入选“中国科学十大进展”(2020与2023年度)、“中国生命科学十大进展”(2020与2023年度)、“中国2023年度重要医学进展”以及2023年度“美国人类遗传学会研究奖”。

相关论文信息

论文原文刊载于Cell Press细胞出版社
旗下期刊Cell
点击“阅读原文”或扫描下方二维码查看论文

▌论文标题:
Single-cell multiregion epigenomic rewiring in Alzheimer’s disease progression and cognitive resilience
▌论文网址:
▌DOI:
https://doi.org/10.1016/j.cell.2025.06.031

▲长按图片识别二维码阅读原文
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢