今天为大家分享一篇发表在《Journal of Advanced Research》(IF = 13)上的研究论文,题目为“Integrating molecular generation and fingerprints transferring for single-molecule theranostics targeting endoplasmic reticulum stress”,论文的通讯作者是来自于中南大学的董界副教授和曾文彬教授,论文第一作者是中南大学博士研究生朱颖丽。

内质网作为细胞中最大的膜性细胞器,在蛋白质合成与折叠中扮演着关键角色。当细胞遭遇氧化应激或营养缺乏时,内质网应激(ERS)会引发包括癌症在内的多种疾病。然而,现有商业染料如ER-Tracker仅能实现单机制靶向,无法同时满足Grp78(葡萄糖调节蛋白78)的精准成像与调控需求。更棘手的是,传统基于水解反应的探针设计策略对非典型水解酶Grp78完全无效,而抗体/多肽探针又存在渗透性差、成本高等缺陷。
针对这一系列挑战,中南大学的研究团队在《Journal of Advanced Research》发表了一项突破性研究。他们开创性地将人工智能技术与化学生物学相结合:首先通过机器学习筛选出控制ER靶向的关键分子指纹(如带正电的MACCS49片段),随后利用自主开发的PM-1深度学习模型,以Grp78的ATP结合口袋为模板从头生成3D分子结构。最具创新性的是,研究人员建立了分子指纹转移技术,将ER导航指纹"嫁接"到生成分子骨架上,最终构建出多功能单分子探针ABT-CN2。
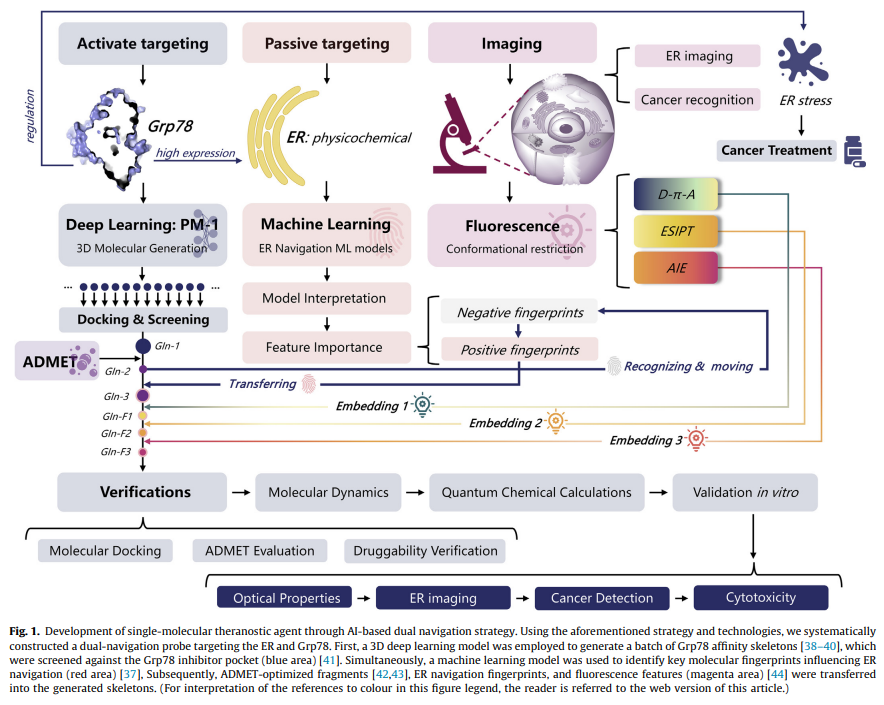
研究主要运用了五项核心技术:1)基于MACCS指纹的随机森林算法预测ER靶向规则;2)PM-1深度学习模型进行3D分子生成;3)分子对接验证Grp78结合亲和力;4)100ns分子动力学模拟评估复合物稳定性;5)TD-DFT量子计算预测荧光特性。
研究结果
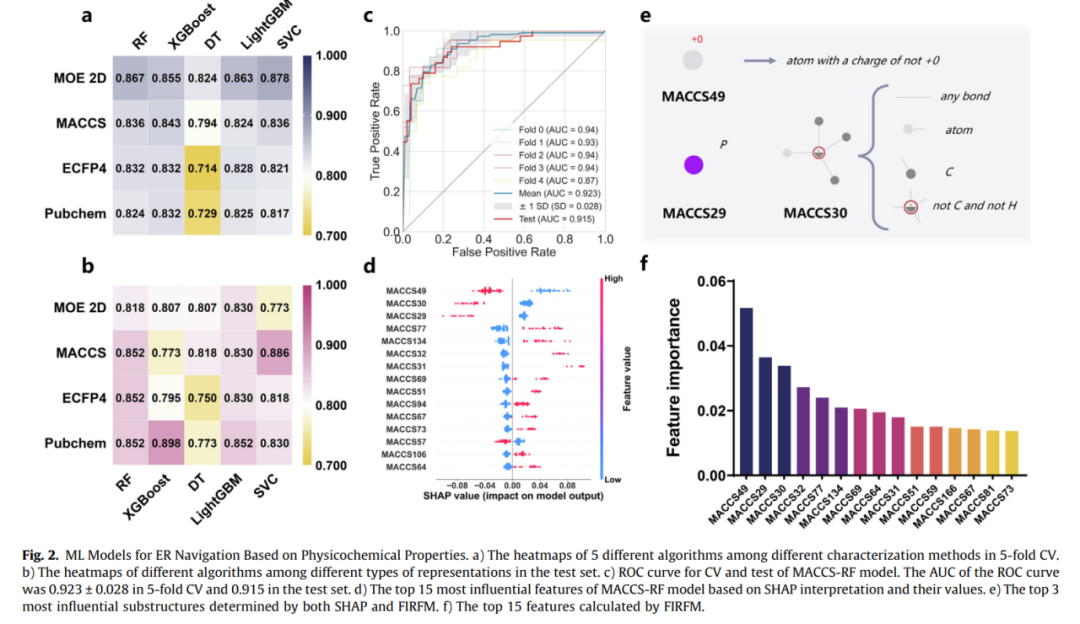
ML模型指导ER被动导航
通过分析156个ER靶向分子数据集,发现带正电的MACCS49、含磷原子的MACCS30等指纹是决定ER靶向效率的关键特征,构建的MACCS-RF模型测试集准确率达0.852。
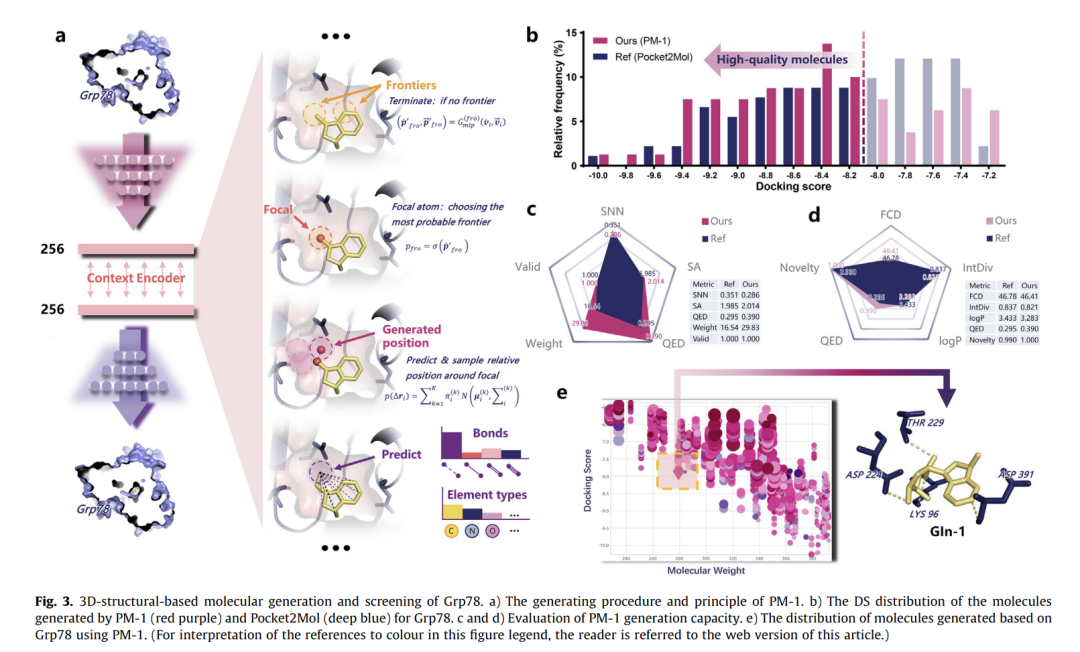
3D分子生成技术
改进的PM-1模型生成的分子与Grp78结合能显著优于基准方法(51% vs 42%高亲和力分子),SNN相似度仅0.286,表明其强大的结构创新性。
指纹转移与结构优化
初始分子GIn-1经ADMET优化和指纹替换后,logD从-1.307提升至3.742,合成难度(SA)从5.615降至2.813,同时保留了对Grp78的结合能力(DS=-7.3160)。
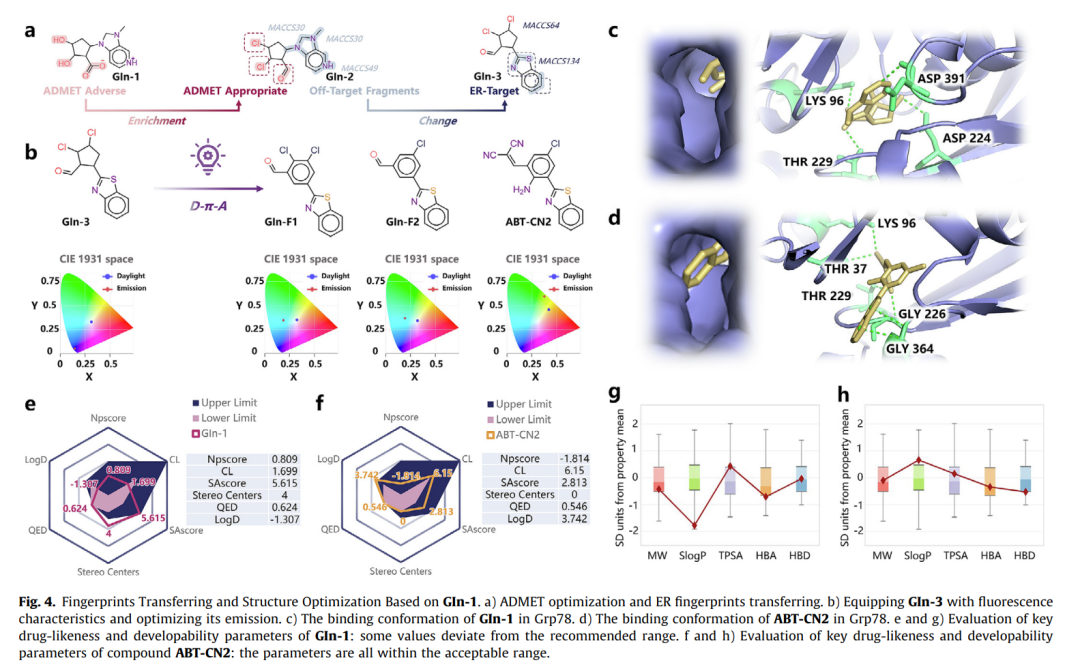
选择性结合机制
分子动力学显示ABT-CN2与Grp78的结合自由能达-33.6080 kcal/mol,关键相互作用残基包括Thr14/Tyr16等。量子计算揭示其ESIPT(激发态分子内质子转移)特性:结合态荧光发射波长547nm,而游离态因构象扭曲导致荧光淬灭。
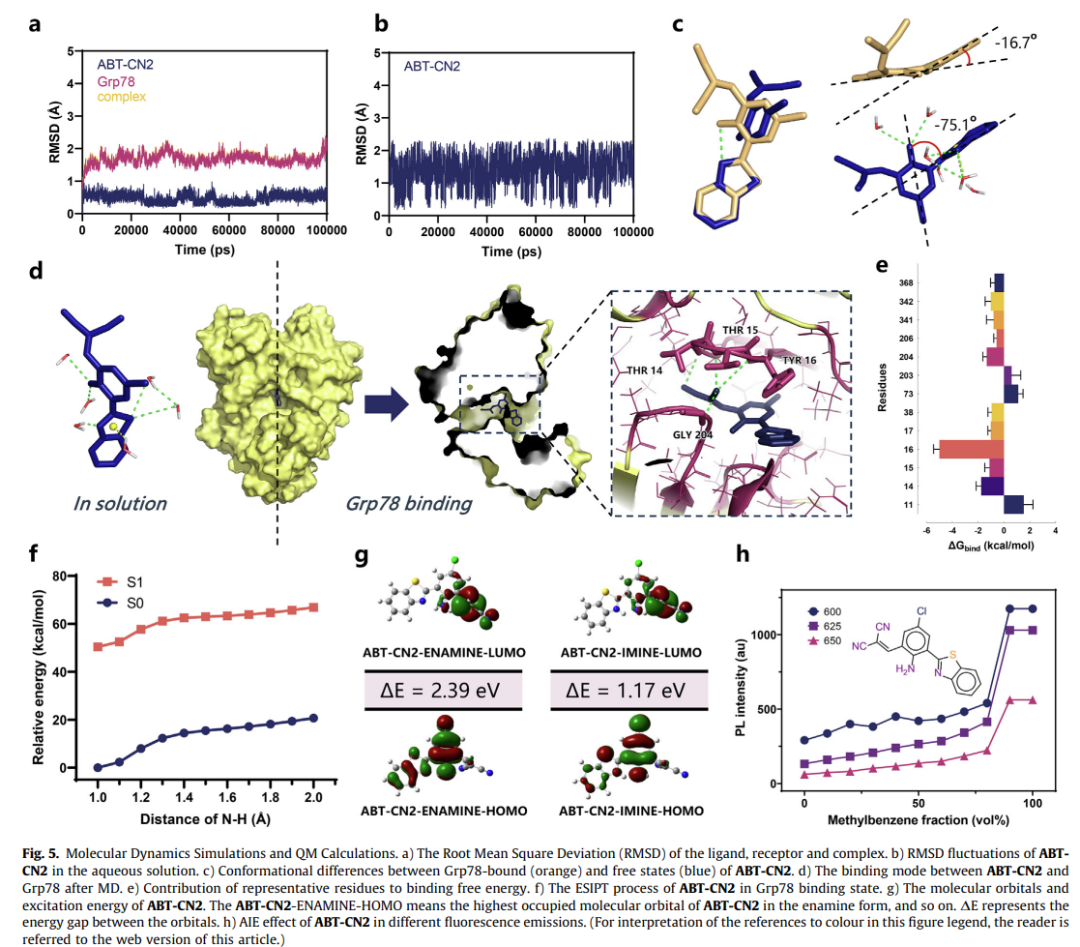
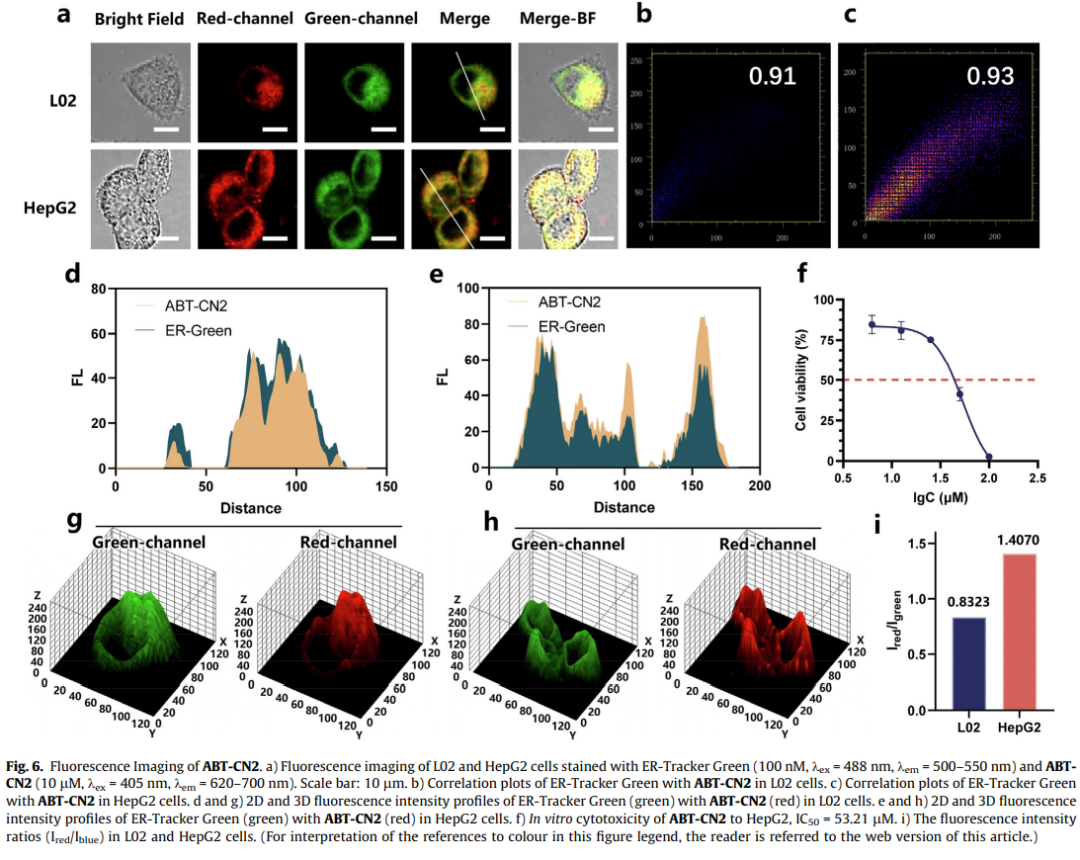
ER成像与肿瘤识别
在肝癌细胞HepG2中,ABT-CN2与ER-Tracker共定位系数达0.93,且红/绿通道荧光强度比(1.4070)显著高于正常肝细胞L02(0.8323),这种差异源自肿瘤细胞更高的Grp78表达水平。CCK-8实验证实其抗肿瘤活性(IC50=53.21μM)。
研究结论
这项研究开创了细胞器双靶向探针设计的新范式:通过ML揭示的物理化学规律实现被动靶向,结合DL生成的3D结构实现主动靶向,最终用单个小分子同步解决了成像、诊断和治疗三大难题。ABT-CN2的成功不仅为癌症诊疗提供了新工具,其分子指纹转移策略更可推广至线粒体、溶酶体等其他细胞器靶向药物的开发。特别值得注意的是,研究首次证明人工智能生成的分子骨架经合理修饰后,可完美整合多种生物功能,这为未来多功能药物设计指明了方向。
参考资料
Zhu, Yingli, Jing Hou, Xiaorong Tan, Weiheng Zhang, Yanpeng Fang, Jie Dong, and Wenbin Zeng. "Integrating molecular generation and fingerprints transferring for single-molecule theranostics targeting endoplasmic reticulum stress." Journal of Advanced Research (2025).
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢