在肿瘤药理学与精准治疗领域,天然产物因其结构多样性和生物活性广谱性,始终是创新药物研发的核心领域之一。然而,天然产物作用靶点模糊、机制解析困难的问题,长期制约着其从“传统应用”向“现代精准药物”的转化。与此同时,雌激素受体阳性(ER+)乳腺癌作为女性发病率最高的恶性肿瘤亚型(占比70%-80%),虽以内分泌治疗为基石,但约30%患者会发展为他莫昔芬耐药,复发后肿瘤侵袭性显著增强,成为临床治疗的“卡脖子”难题。
近期,中南大学药学院联合中南大学湘雅医院、中南大学湘雅二医院、四川大学华西医院等团队发表于《Nature Communications》的研究论文“Harnessing artificial intelligence to identify Bufalin as a molecular glue degrader of estrogen receptor alpha”,通过AI驱动的靶点预测-多维度实验验证-分子机制解析-临床前疗效评估的系统研究框架,首次揭示传统中药活性成分蟾毒灵(Bufalin)作为“分子胶”降解ERα的全新机制,并证实其可有效逆转他莫昔芬耐药,为ER+乳腺癌治疗提供了兼具“传统智慧”与“现代科技”的新策略。

一、研究设计:破解天然产物靶点难题的“AI+实验”双轮驱动体系
天然产物的靶点鉴定是药物研发的关键瓶颈,传统实验筛选方法存在周期长、成本高、通量低的局限。本研究创新性地构建了“计算预测-实验验证-机制深挖”的三阶研究体系,核心在于将AI技术与分子生物学实验深度融合,实现靶点的精准定位与机制的系统解析。
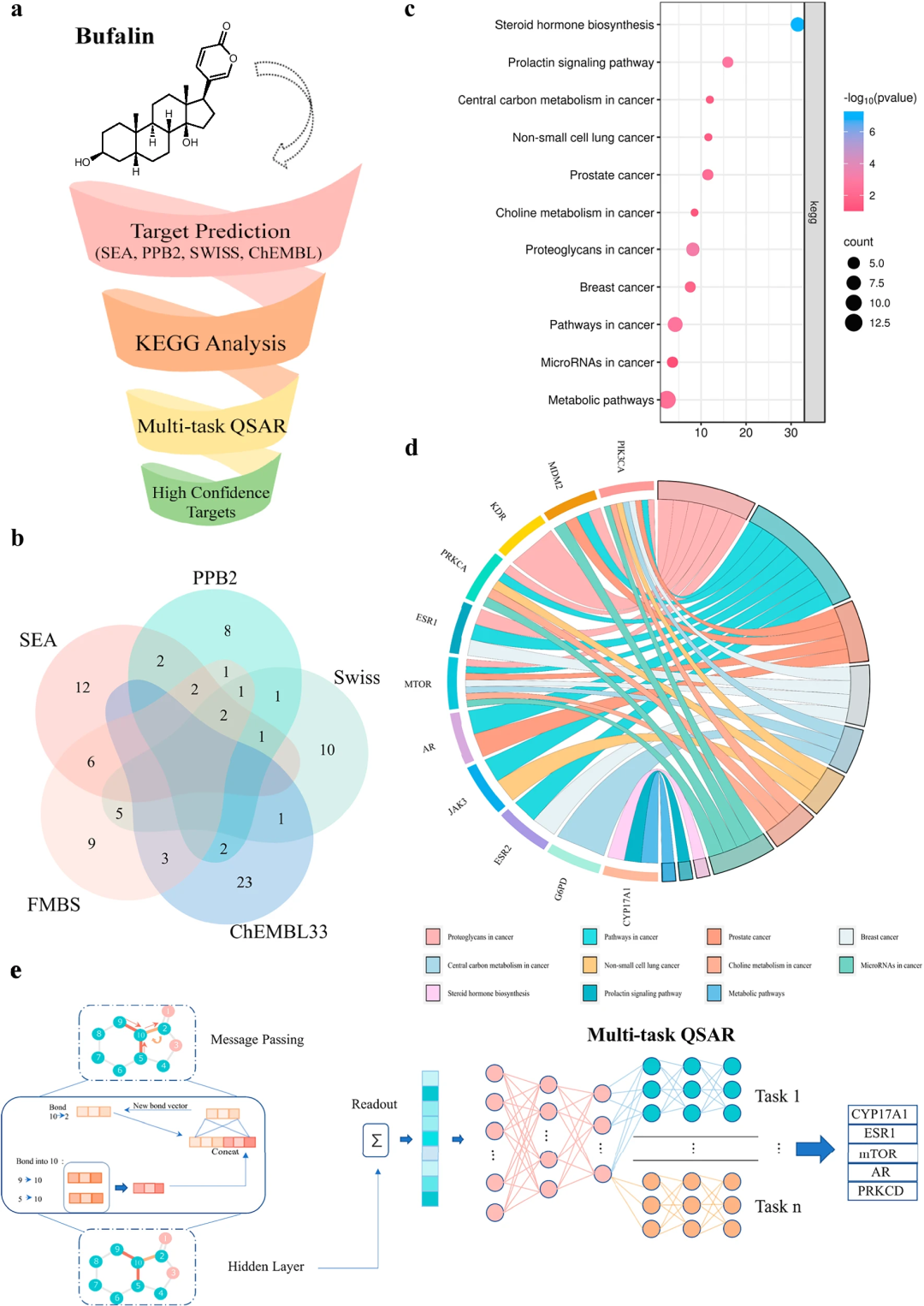
(一)AI介导的多维度靶点预测:从“广谱筛选”到“精准聚焦”
研究团队首先针对蟾毒灵的靶点预测设计了整合式多策略模型,以解决单一预测平台的局限性:
1. 初始靶点池构建:采用融合多生物特征(FMBS)策略,结合Swiss Target Prediction、SEA、PPB2、ChEMBL33四大主流靶点预测平台,利用不同算法的互补性生成初始靶点数据集,通过交集筛选获得53个高可信度候选靶点,初步缩小研究范围; 2. 通路富集优化:对53个候选靶点进行KEGG通路富集分析,聚焦与肿瘤发生发展直接相关的信号通路(如乳腺癌通路、癌症中的胆碱代谢、PI3K-AKT通路等),通过弦图可视化通路-靶点关联关系,进一步筛选出11个关键靶点; 3. 多任务QSAR模型验证:基于Chemprop框架构建多任务定量构效关系(QSAR)神经网络模型,以11个关键靶点的1187个化合物结合数据为训练集(80%训练/20%测试),模型ROC-AUC达0.94,具备高预测准确性。以0.8为概率阈值,最终确定CYP17A1、ESR1(编码ERα)、mTOR、AR、PRKCD为5个核心潜在靶点。
该预测体系的优势在于:通过“多平台整合-通路过滤-AI建模验证”的层层递进,既避免了单一算法的偏差,又通过生物学意义筛选确保靶点与肿瘤的关联性,为后续实验验证提供了明确方向。
(二)实验验证:从“体外结合”到“细胞功能”的全维度确认
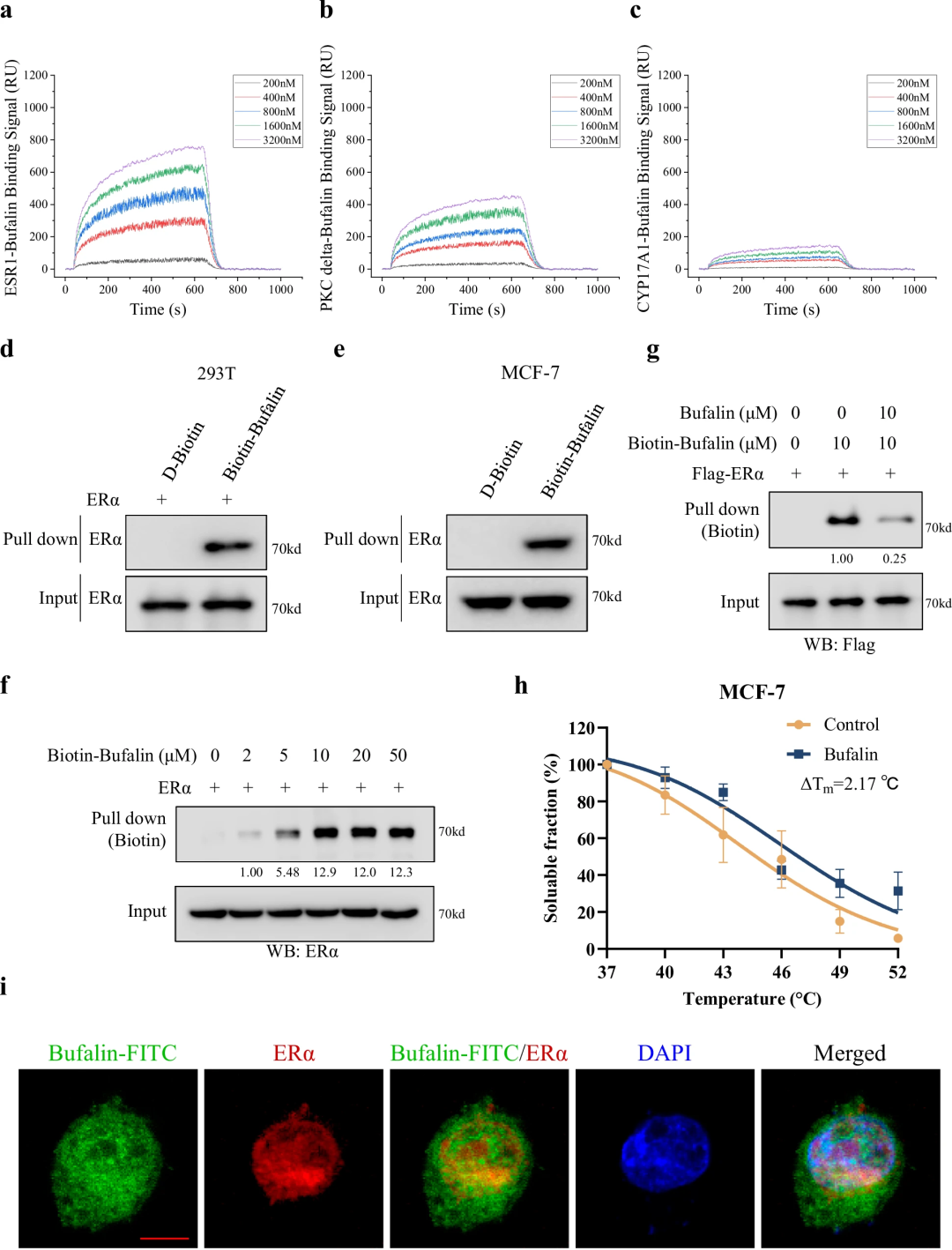
针对AI预测的5个靶点,研究团队通过阶梯式实验验证,明确ERα为蟾毒灵的核心作用靶点:
1. 亲和力排序(SPR实验):采用表面等离子体共振(SPR)技术检测蟾毒灵与重组CYP17A1、ESR1、PRKCD蛋白的结合能力,结果显示ERα与蟾毒灵的解离常数(KD=5.42×10⁻⁶ M)远低于CYP17A1(2.94×10⁻² M)和PRKCD(1.29×10⁻² M),证实ERα是三者中结合亲和力最强的靶点; 2. 特异性验证(Biotin pulldown实验):合成生物素标记的蟾毒灵(Biotin-Bufalin),在293T细胞(过表达ERα)和MCF-7细胞(内源性ERα)中进行下拉实验,结果显示Biotin-Bufalin可特异性捕获ERα,且结合具有剂量依赖性,游离蟾毒灵可竞争性抑制该结合,排除非特异性相互作用; 3. 功能相关性验证(CETSA与共定位实验):热位移实验(CETSA)显示蟾毒灵可使ERα的熔解温度(Tm)升高2.17℃,表明其可稳定ERα蛋白构象;免疫荧光实验观察到蟾毒灵(FITC标记)与ERα在MCF-7细胞核内共定位,进一步证实两者在细胞内的直接相互作用。
这一系列实验从“体外分子结合”到“细胞内定位与构象影响”,形成了完整的证据链,明确ERα是蟾毒灵在ER+乳腺癌中的关键作用靶点,为后续机制研究奠定基础。
二、核心机制:蟾毒灵作为“分子胶”促进ERα泛素-蛋白酶体降解的全新范式
明确ERα为靶点后,研究团队围绕“蟾毒灵如何调控ERα功能”展开深入探究,最终揭示其作为分子胶增强ERα与E3泛素连接酶STUB1相互作用、诱导ERα降解的全新机制,这也是本研究最核心的科学突破。
(一)ERα降解的调控方式:泛素-蛋白酶体途径的特异性激活
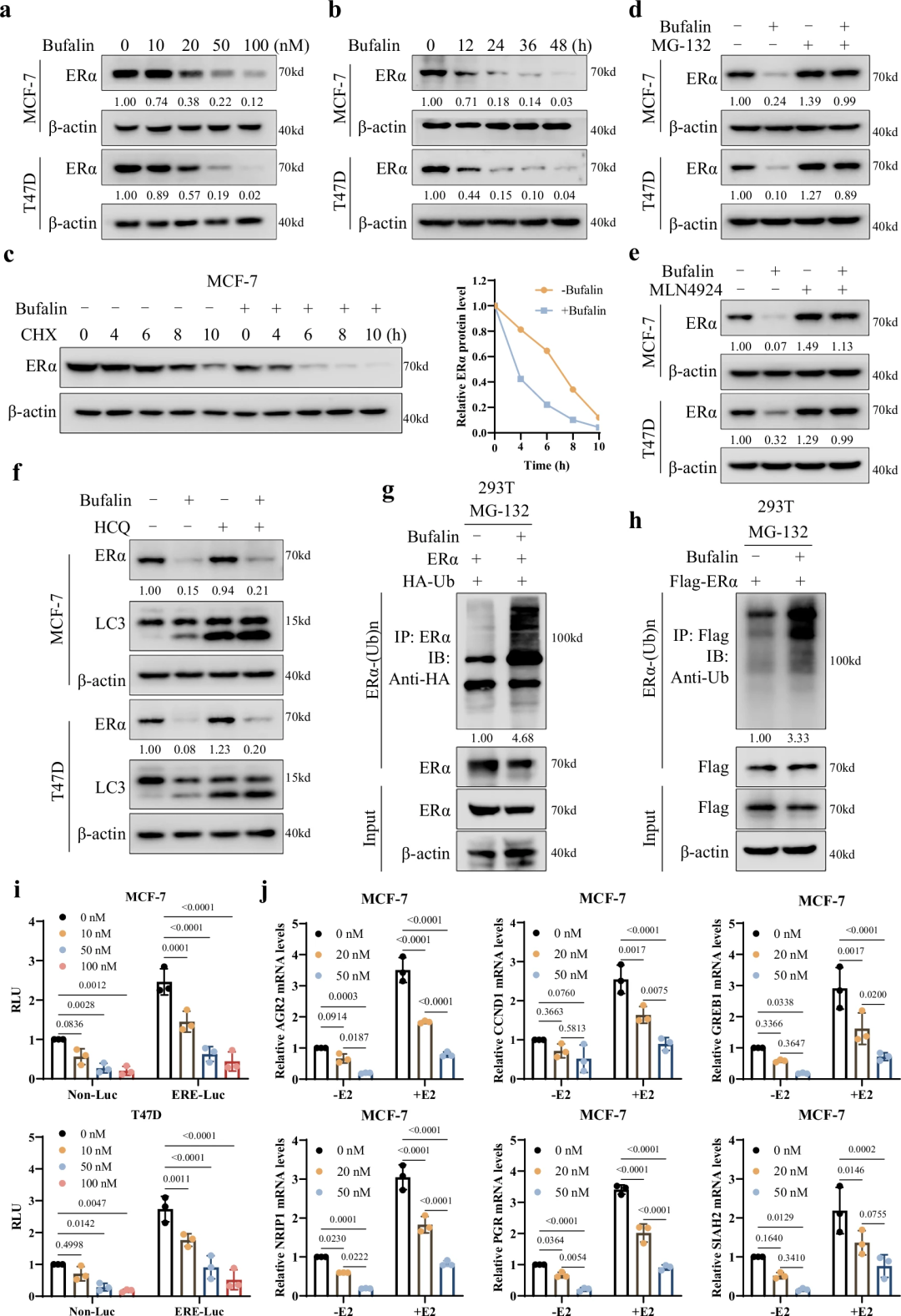
首先,研究通过剂量/时间依赖性实验与通路抑制剂干预,明确蟾毒灵对ERα的调控为“转录后降解”:
1. 降解特征:Western blot显示,蟾毒灵以剂量(0-100 nM)和时间(0-48 h)依赖性方式降低MCF-7、T47D细胞中ERα蛋白水平,但qPCR结果显示ERα mRNA表达无显著变化,排除转录抑制机制; 2. 降解途径确认:环己酰亚胺(CHX,蛋白合成抑制剂)追踪实验显示,蟾毒灵可加速ERα蛋白降解速率;蛋白酶体抑制剂MG-132可完全逆转蟾毒灵诱导的ERα下调,而溶酶体抑制剂羟氯喹(HCQ)无明显作用;泛素激活酶抑制剂MLN4924同样可减弱ERα降解,提示降解依赖泛素-蛋白酶体途径; 3. 泛素化水平验证:共免疫沉淀(Co-IP)实验显示,蟾毒灵处理后,ERα的泛素化修饰水平显著升高(以HA-Ub或Flag-ERα为靶点检测),直接证实其通过促进ERα泛素化实现降解。
(二)分子胶作用的结构基础:Arg394为核心结合位点
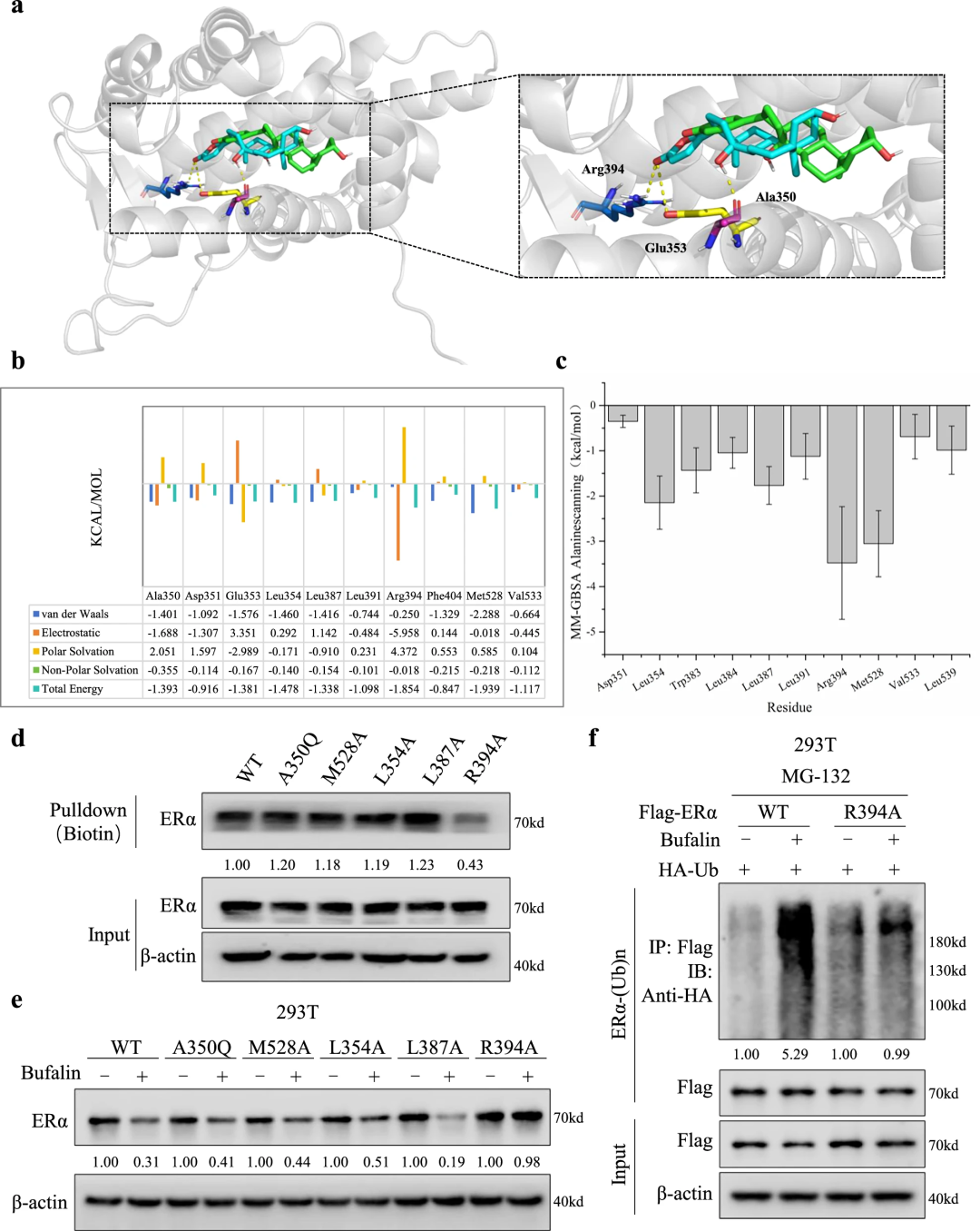
为明确蟾毒灵与ERα的结合细节,研究通过分子对接与突变实验,锁定Arg394为关键结合残基:
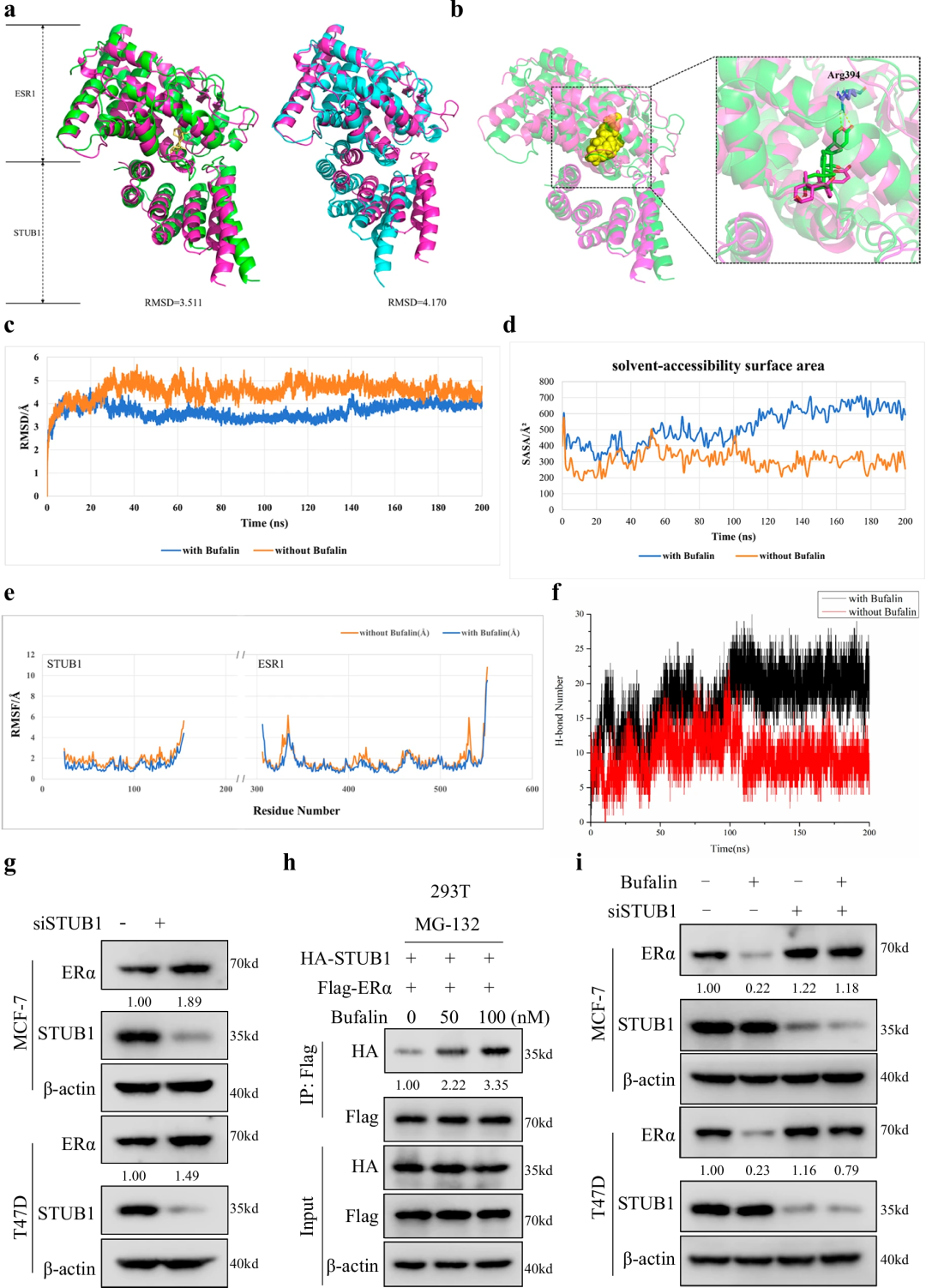
1. 分子对接与MD模拟:采用Glide SP协议将蟾毒灵对接至ERα结合口袋(PDB ID: 3ERT),经100 ns分子动力学(MD)模拟与MM-GBSA能量计算,发现Leu354、Leu387、Arg394、Met528、Ala350为能量贡献>-1 kcal/mol的关键残基; 2. 丙氨酸扫描突变验证:构建ERα单点突变体(Leu354A、Leu387A、Arg394A、Met528A、Ala350Q),在293T细胞中进行Biotin pulldown实验,结果显示仅Arg394A突变完全丧失与Biotin-Bufalin的结合能力;进一步的降解实验显示,Arg394A突变体的ERα降解效率显著降低,泛素化水平也随之下降。
这一结果表明,Arg394是蟾毒灵与ERα结合的“不可替代位点”,其突变会完全阻断蟾毒灵的后续调控作用,为后续结构优化提供了明确的分子靶点。
(三)分子胶功能的关键效应:增强ERα与STUB1的相互作用
分子胶的核心功能是“诱导靶点蛋白与E3泛素连接酶的 proximity”,本研究通过MD模拟与功能实验,证实蟾毒灵可增强ERα与STUB1的相互作用:
1. E3连接酶筛选:基于已有研究,选择与ERα降解相关的E3连接酶(TRIM56、RNF181、RNF2、STUB1)进行MD模拟,结果显示:蟾毒灵存在时,ERα与STUB1的结合自由能从-4.9455 kcal/mol降至-58.1918 kcal/mol,而与其他E3连接酶的结合能无显著变化,提示STUB1是蟾毒灵作用的特异性E3连接酶; 2. 相互作用增强的结构证据:200 ns MD模拟显示,蟾毒灵结合ERα后,会诱导ERα构象发生细微改变(如Arg394形成氢键),使ERα与STUB1的结合表面积增加、氢键数量增多(模拟后期氢键数达3-4个),且ERα-STUB1复合物的RMSD值更稳定(<3.5 Å),表明复合物构象更稳定; 3. 功能验证(STUB1沉默实验):在MCF-7、T47D细胞中沉默STUB1后,蟾毒灵诱导的ERα降解效率显著降低,ERα泛素化水平也随之下降;Co-IP实验进一步证实,蟾毒灵可显著增强ERα与STUB1的相互作用。
这些结果清晰揭示:蟾毒灵通过“分子胶”机制,一方面与ERα的Arg394结合,另一方面诱导ERα构象改变以增强其与STUB1的相互作用,最终促进ERα泛素化降解——这是天然产物中罕见的分子胶作用模式,为分子胶药物的研发提供了新的天然模板。
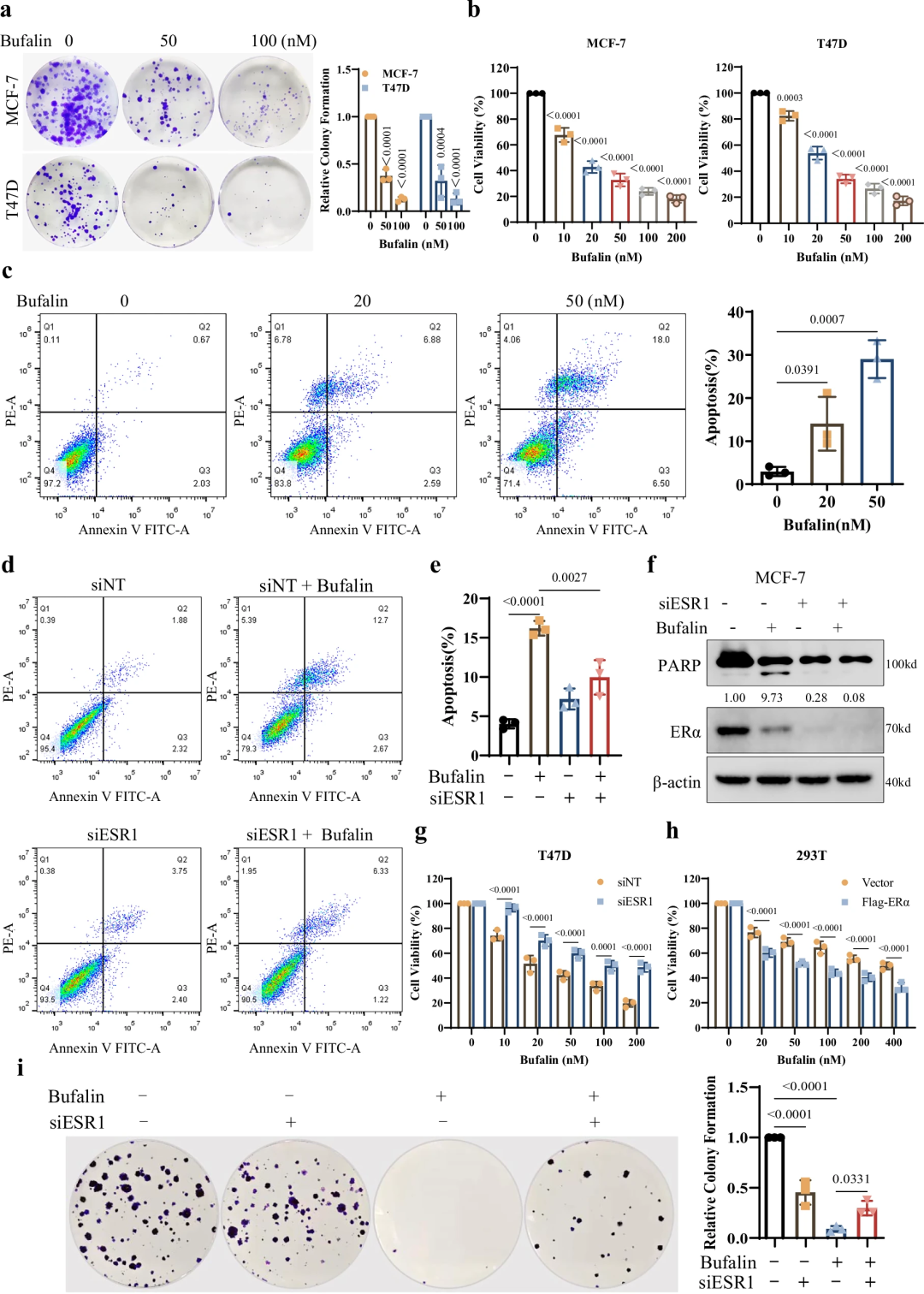
三、功能价值:从“细胞活性”到“临床前疗效”的全场景验证
机制解析后,研究团队通过ERα依赖性验证与耐药模型评估,全面证实蟾毒灵的抗肿瘤活性及逆转他莫昔芬耐药的潜力,为临床转化提供了扎实证据。
(一)ERα依赖性:蟾毒灵抗肿瘤活性的核心前提
为明确ERα降解与抗肿瘤活性的因果关系,研究通过ERα沉默/过表达实验进行验证:
1. 增殖抑制与凋亡诱导:CCK-8和集落形成实验显示,蟾毒灵可显著抑制MCF-7、T47D细胞增殖(IC50分别为20 nM、30 nM);Annexin V-PI染色显示,50 nM蟾毒灵处理48 h可使凋亡率提升至25%-30%,且凋亡标志物(切割型PARP)表达升高; 2. ERα依赖性验证:siRNA沉默ERα后,蟾毒灵诱导的细胞凋亡率下降50%以上,增殖抑制效应显著减弱;而过表达ERα的293T细胞对蟾毒灵的敏感性显著增强(IC50降至10 nM)。
这一结果证实:蟾毒灵的抗肿瘤活性完全依赖于ERα的存在,ERα降解是其发挥疗效的核心机制,排除了其他非特异性作用的干扰。
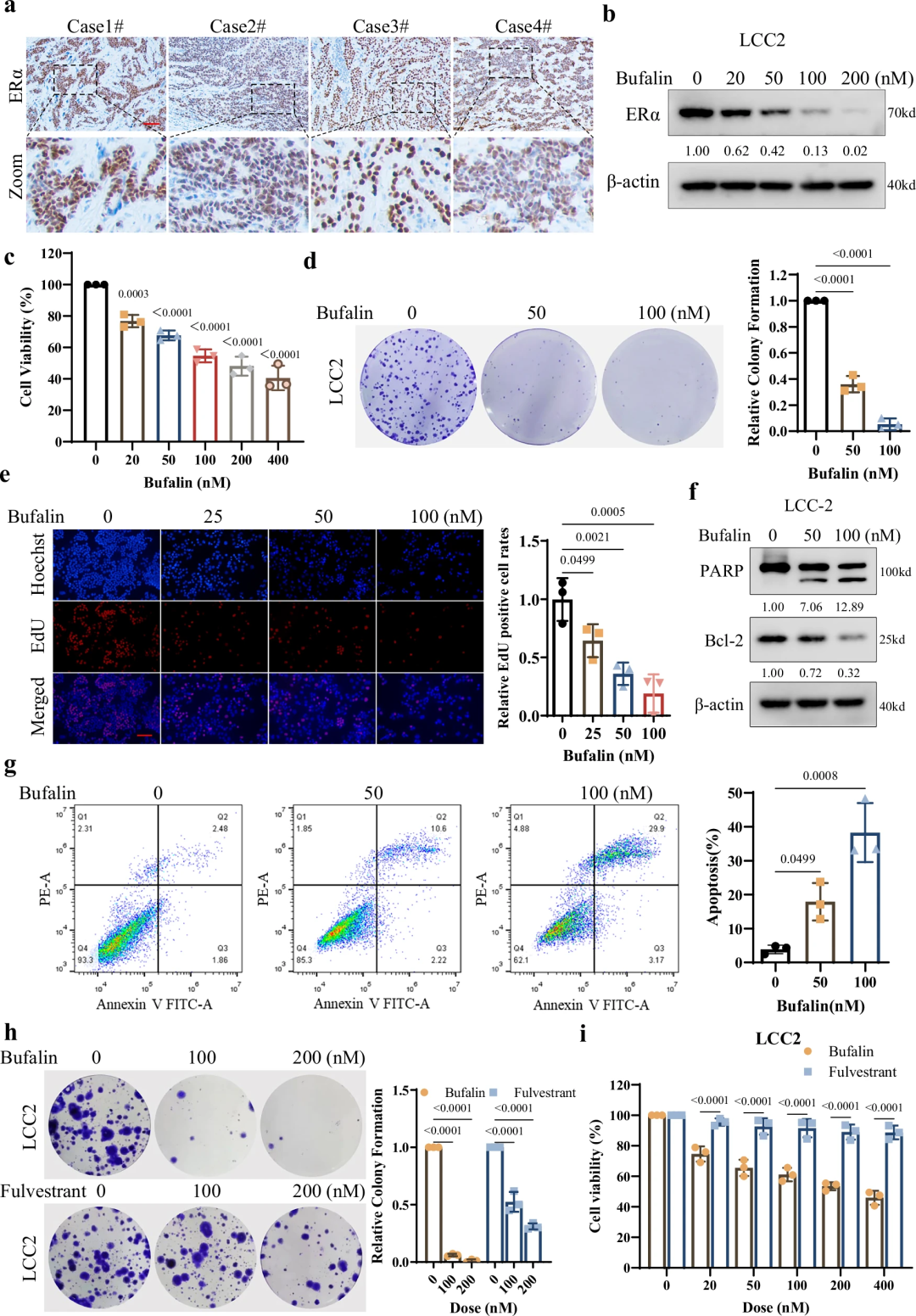
(二)他莫昔芬耐药逆转:从“细胞系”到“PDO”的全维度疗效
针对临床核心需求,研究团队在耐药细胞系、动物模型、患者来源类器官(PDO) 中系统评估蟾毒灵的疗效:
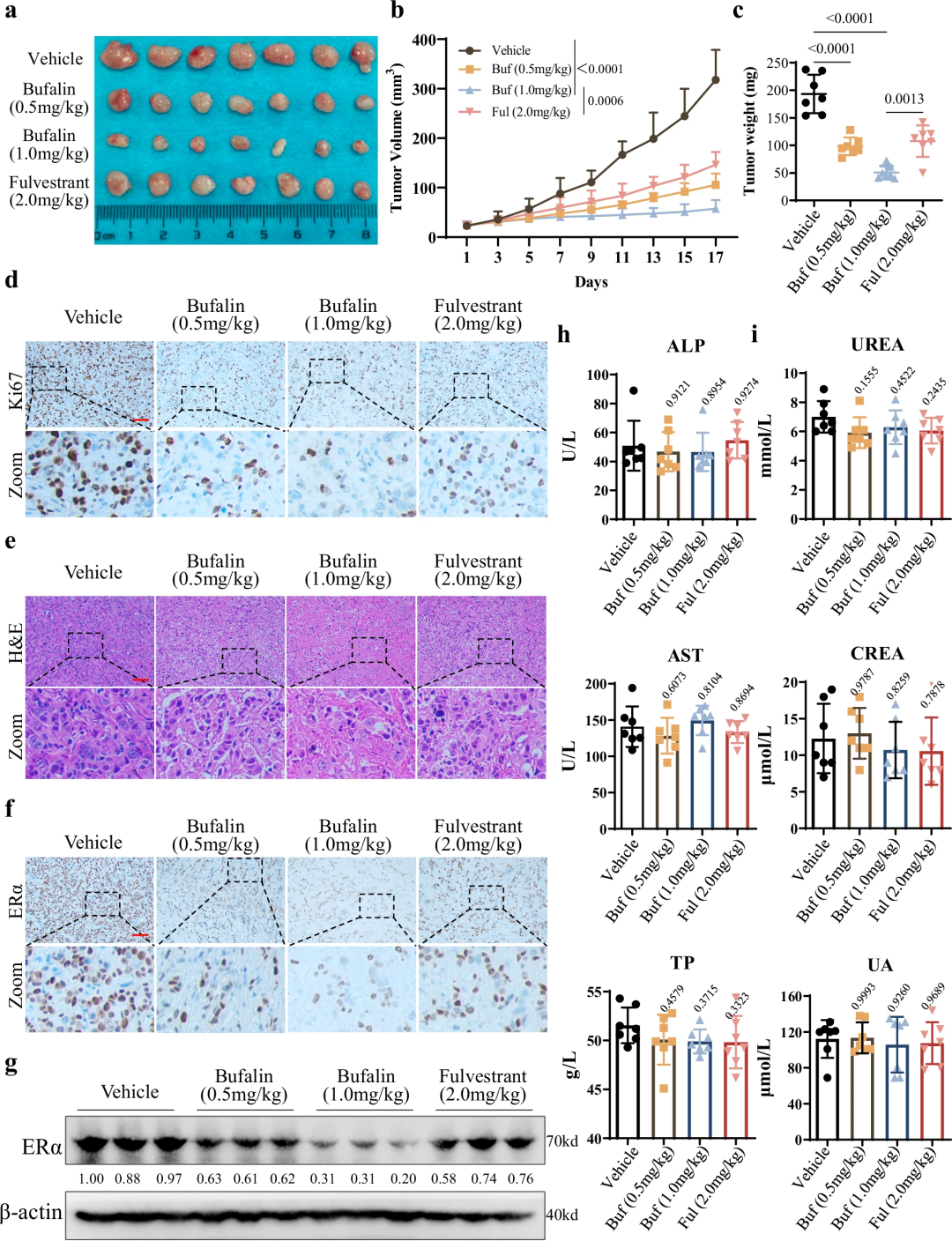
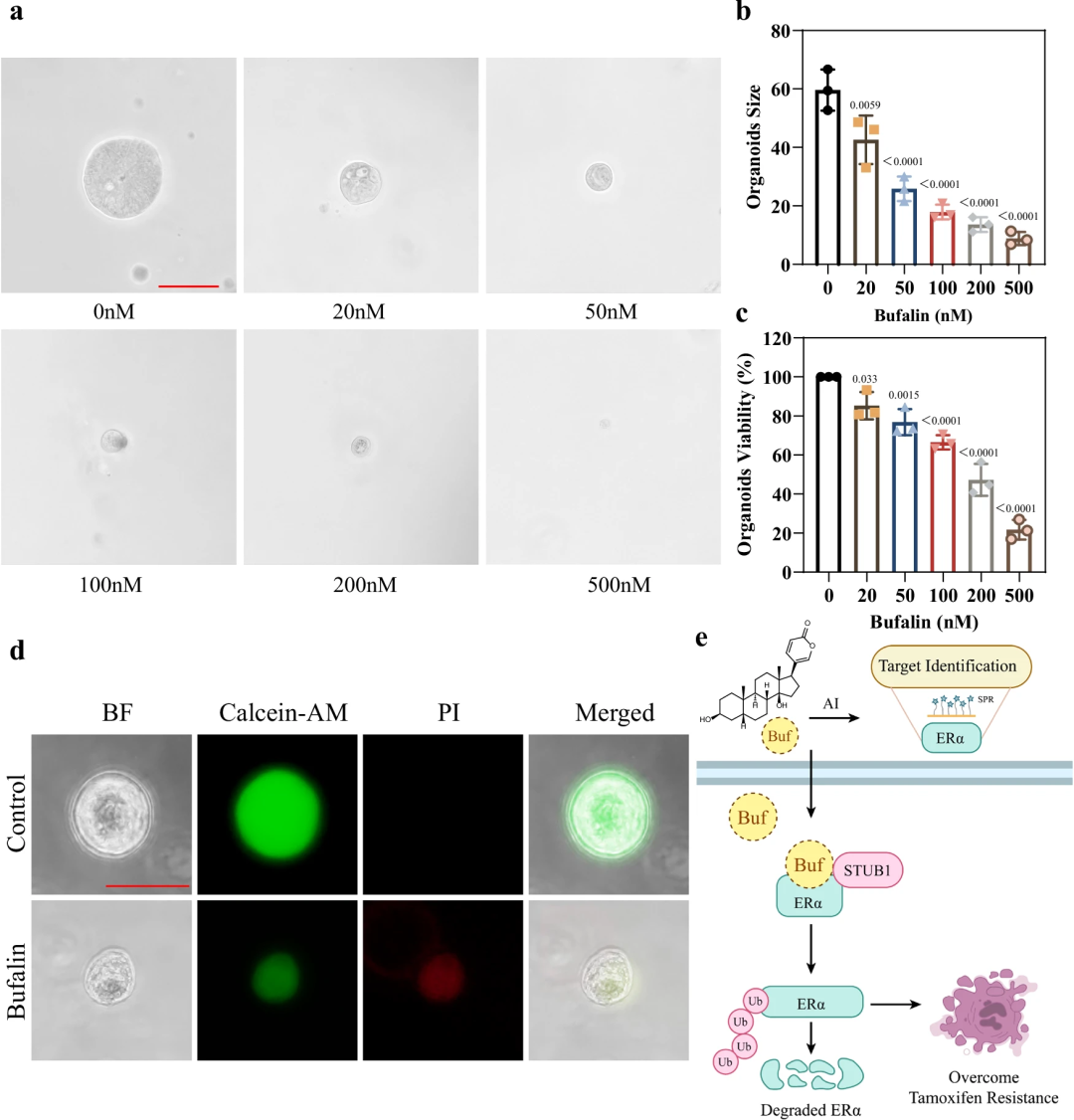
1. 耐药细胞系(LCC2)中的活性:LCC2细胞是经典的他莫昔芬耐药细胞系,Western blot显示蟾毒灵仍可有效降解LCC2中的ERα;CCK-8、集落形成、EdU实验证实,蟾毒灵以剂量依赖性方式抑制LCC2增殖(IC50=40 nM),且疗效优于氟维司群(IC50=80 nM);凋亡实验显示,100 nM蟾毒灵可使LCC2凋亡率达35%,显著高于氟维司群(20%);(图7) 2. 体内疗效与安全性:在LCC2裸鼠皮下移植瘤模型中,腹腔注射蟾毒灵(0.5 mg/kg、1.0 mg/kg)可使肿瘤体积缩小40%-60%,肿瘤重量降低50%-70%,且肿瘤组织中ERα蛋白水平下降、Ki67(增殖标志物)表达降低;血清生化指标(ALT、AST、BUN、CREA)检测显示,治疗剂量的蟾毒灵对小鼠肝肾功能无显著影响,安全性良好;(图8) 3. 患者来源类器官(PDO)验证:从8例他莫昔芬复发患者的肿瘤组织中构建PDO模型,结果显示:蟾毒灵(50-200 nM)可使PDO体积缩小50%-80%,细胞活力降低60%-90%;Calcein-AM/PI染色显示,蟾毒灵处理后PDO内死细胞(PI阳性)比例显著升高,证实其在临床样本中的疗效。(图9)
这一系列实验从“体外耐药细胞”到“体内动物模型”,再到“临床患者样本衍生的PDO”,形成了完整的临床前疗效证据链,充分证实蟾毒灵可有效逆转他莫昔芬耐药,且安全性良好,具备极高的临床转化价值。
四、研究的科学价值与未来展望
本研究不仅为ER+乳腺癌耐药治疗提供了新的候选药物,更在天然产物机制解析、AI辅助药物研发等领域具有重要的科学意义:
1. 天然产物靶点解析的范式创新:首次将AI多任务模型与分子生物学实验结合,建立了“预测-验证-机制”的系统框架,解决了天然产物靶点模糊的难题,为其他天然产物的机制研究提供了可推广的方法学参考; 2. 分子胶药物的新发现:蟾毒灵是首个被证实具有ERα分子胶功能的天然产物,其作用模式(结合Arg394增强ERα-STUB1相互作用)为分子胶药物的设计提供了新的结构模板,突破了传统分子胶多为合成小分子的局限; 3. 临床转化的明确方向:基于Arg394结合位点,可进一步开展蟾毒灵的结构优化,开发亲和力更强、毒性更低的衍生物;同时,可探索蟾毒灵与CDK4/6抑制剂、免疫检查点抑制剂的联合治疗策略,进一步提升ER+乳腺癌的治疗效果。
综上,该研究通过AI技术赋能天然产物机制解析,不仅揭示了蟾毒灵作为ERα分子胶降解剂的全新作用模式,更为他莫昔芬耐药乳腺癌患者提供了新的治疗希望,是“传统中药现代化”与“精准肿瘤治疗”交叉融合的典范之作。
参考文献
Jiang, S., Liu, K., Jiang, T. et al. Harnessing artificial intelligence to identify Bufalin as a molecular glue degrader of estrogen receptor alpha. Nat Commun 16, 7854 (2025). https://doi.org/10.1038/s41467-025-62288-7
代码:
https://github.com/wei-xiao-ya/multi_task-NN
https://github.com/LiHui-CADD/pro1-pro2-lig/tree/master
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢