定量系统药理学(Quantitative Systems Pharmacology,QSP)为整合多种生物学、生理学和药理学数据提供了机制性框架,以预测药物相互作用和临床结果。人工智能的最新进展有望通过提升模型生成、参数估计以及预测能力来变革QSP。由AI驱动的数据库和基于云的平台可能会支持QSP模型开发,并推动“QSP即服务”(QSPaaS)的实现。然而,计算复杂度高、高维性、可解释性、数据整合以及监管认可等挑战依然存在。
2025年8月6日,爱丁堡大学、MMWR LTD以及InSysBio的研究人员在《Drug Discovery Today》上发表题为《Revolutionizing drug discovery:Integrating artificial intelligence with quantitative systems pharmacology》的综述文章。

背景
QSP日益被视为现代药物开发中不可或缺的工具,能够为复杂生物系统与网络中的药物相互作用提供机制性见解。具体而言,QSP模型的应用主要集中在药物开发的早期阶段(Ⅰ期和Ⅱ期)。QSP通过对靶点/受体占有率(target/RO)的描述、机制性剂量-反应模拟、首次人体试验(FIH)及推荐Ⅱ期剂量(RP2D)的选择,以及自适应试验设计,提升了早期临床试验的质量与效率。在中枢神经系统(CNS)疾病领域的应用表明,QSP能够为跨越血脑屏障的药物靶向策略以及受体特异性动力学提供基于模型的决策支持。
传统QSP模型采用数学框架,包括微分方程系统、基于主体的模拟以及逻辑网络表示等,用于整合生物学数据并预测治疗反应、不良反应以及最佳给药方案。尽管这些方法具有重要价值,但由于模型开发和参数估计所需的复杂性和高计算强度,它们仍面临显著挑战。近年来,人工智能(AI)尤其是机器学习(ML)、深度神经网络(DNNs)以及大型语言模型(LLMs)的发展,为传统QSP方法提供了变革性的提升。DNNs通过优化参数估计、处理多尺度生物数据并整合大型数据集,提高了QSP模型的准确性。像BioGPT和BioBERT这样的大语言模型正在革新生物医学知识提取,它们能够自动化文献挖掘、识别生物通路并优化药物开发假设。这些AI驱动的技术实现了数据处理自动化、参数提取优化,并能够快速模拟复杂生物行为,从而显著提升模型的可扩展性、准确性和临床相关性。
在本综述中,作者重点介绍了AI方法在QSP工作流程中的整合,特别关注其在生成稳健、可扩展且可转化为临床应用模型方面的潜力。探讨了这些创新如何加速药物发现进程并降低相关开发成本。
QSP中复杂性降低与代理模型
QSP建模的主要挑战之一,是在模拟细致的机制模型时仿真计算成本高,尤其模拟整个生物系统的长时间过程,或在大规模虚拟人群中进行计算时,这一问题尤为突出。AI通过作为一种非参数化工具来实现模型阶数降低,能够用代理模型来近似复杂模型,从而在保持输出行为的前提下显著降低计算成本。人工神经网络(ANNs)可用于生成代理模型,以近似QSP模型中的剂量-反应关系以及其他输入-输出映射,与全阶QSP模型相比,代理模型可大幅减少仿真时间。这类模型不仅能加快敏感性分析与不确定性量化,还能够快速探索不同的治疗方案。在AI框架下部署的特征选择算法,也能通过识别最小但信息量极高的分子描述符或动力学参数子集来进一步降低模型复杂性,从而去除冗余信息,并将计算资源集中于系统行为的关键驱动因素。结合这些方法与QSP模型固有的机制性见解,研究人员能够开发出既可解释又具备计算可行性的混合模型,从而最终促进更高效的药物开发。
用于系统生物学模型探索的AI工具
公共AI工具的最新进展,使研究人员能够以交互方式查询、可视化并解释复杂的系统生物学模型。Kannan等人展示了如何利用LLMs来导航和解析来自BioModels等资源库的形式化模型,这些模型采用了多种系统生物学格式(如SBML、BioPAX、SBGN)。在一项评估中,公共LLMs被测试其回答系统生物学格式中编码的生物反应网络问题的能力。结果发现,ChatGPT、MetaAI和Copilot在分析系统生物学中的数学表达式时表现不佳,而HyperWrite和Perplexity AI则能够正确解释系统生物学模型。此类工具可作为模型资源库的前端接口,提升QSP建模人员对模型的获取与利用效率。
研究显示,LLMs能够概述模型结构、模拟结果,并提出扰动实验建议,这些能力可直接应用于优化QSP工作流程与情景测试。由于QSP模型通常采用SBML标准,能够理解SBML语法与语义的AI工具,可加速模型的翻译与假设生成。通过将机制性系统生物学模型与基于AI的文献挖掘及仿真工具相结合,研究人员可以自动更新或验证QSP的假设。将此类AI代理嵌入云平台,可以使非专业用户也能以交互方式生成、探索或测试QSP模型,从而拓展“QSP即服务”(QSPaaS)的概念。
生成式人工智能与QSP
生成式人工智能涵盖了大型语言模型和深度生成模型等技术,正日益影响QSP的研究与应用格局。这些AI模型通过生成新假设、自动化模型构建,以及促进新型治疗药物设计,正在提升药物发现与开发的多个环节。生成式AI模型已展现出设计具有特定药理学特性的全新分子结构的能力。例如,Insilico Medicine利用GAN和强化学习创造了新的候选药物,其中部分已进入临床试验阶段。将生成式AI融入QSP可推动模型开发流程的自动化。例如,Certara的“QSP产业化”方法利用生成式AI优化模型生命周期,包括证据聚合、用于模型设计的代码生成,以及自动化报告生成。这一整合提升了QSP建模工作的效率与可扩展性。
虚拟患者
药理学建模中的一个关键挑战是如何捕捉患者群体中存在的显著异质性,这种差异会影响治疗效果和不良事件风险。AI为解决这一问题提供了强有力的工具。基于AI的聚类与分类方法可将患者数据分为具有不同反应特征的亚群,从而帮助识别响应者与非响应者,并指导个性化治疗策略。在早期临床试验中,模拟异质性患者群体尤为重要,因为理解个体差异对于优化给药方案和预测不良事件至关重要。
虚拟患者群体与数字孪生的区分。(1)虚拟患者群体:通过计算机生成的模拟个体群体,反映人体生理、疾病进程和药物反应的差异,这些差异是通过在合理范围内调整关键生物学参数来实现的。虚拟患者用于探索治疗结果、优化给药方案以及支持临床试验设计。基于AI的方法,尤其是GANs和基于流的模型,已成功用于生成这些虚拟队列,使得在不同情景下能够稳健地模拟临床试验结果。(2)数字孪生:是从统计学队列演进而来的概念,代表针对特定个体生理状态的动态计算复制体。数字孪生整合患者特异性数据,以实时模拟个体化疾病轨迹,并预测个性化药物反应。
人工智能、QSP与药物发现和开发
将AI整合到QSP建模中,已经显著提升了药物发现流程与临床试验设计的效率。结合AI增强的QSP模型的计算虚拟试验模拟,已被用于在昂贵且耗时的临床研究之前预测新型治疗化合物的疗效与安全性。例如,在免疫肿瘤学领域,ML常用于从多组学数据中识别生物标志物。这些生物标志物可用于在QSP模型中对虚拟患者队列进行分层,从而指导最优治疗组合与给药策略的选择(图1)。
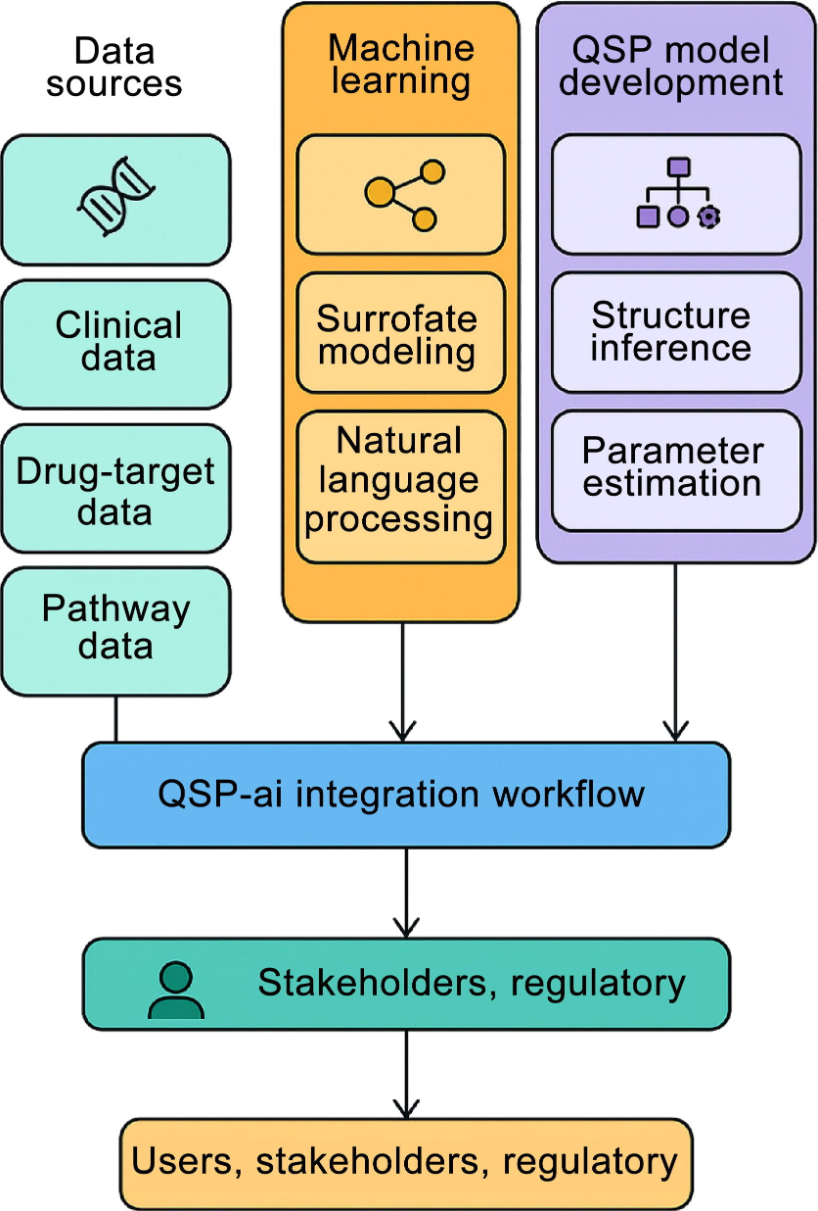
图1 整合AI到QSP模型的工作流
同样,在神经退行性疾病研究中,融合AI/ML信息的QSP模型可加深对复杂神经网络动力学及中枢神经系统药物相互作用的理解,从而更精准地识别治疗靶点,并更准确地预测临床结局。此外,AI增强的QSP模型还可用于优化多药联合用药策略,通过整合药物-药物相互作用及药效学协同作用数据,模拟在多种共病疾病中联合治疗的效果。这种综合方法不仅提高了临床结局预测的准确性,还可通过提供剂量选择与试验设计的机制性依据,支持监管决策。
构建和验证QSP模型的严格性,对于确保预测结果的稳健性和临床可转化性至关重要。基于AI的自然语言处理工具正越来越多地被用于自动化提取科学文献中的动力学参数与机制信息,从而减少人工整理工作量,加速模型构建过程。此外,机器学习方法还能通过将模拟结果与多尺度实验数据进行比较来促进模型验证,并迭代优化模型参数,直到收敛于具有临床相关性的预测结果。将网络基础设施平台与可查找、可获取、可互操作、可重复使用数据原则整合到QSP工作流程中,还能进一步提升模型在跨学科团队间的可重复性与数据共享性,确保AI增强的QSP模型在新的实验和临床信息出现时可以持续更新。这种在AI支持下的迭代模型优化,建立了一个贯穿体外-体内-临床的计算连续体,最终增强了QSP建模的转化影响力。
将检索增强生成整合到QSP中
检索增强生成(Retrieval-Augmented Generation, RAG)是一种AI框架,将LLMs的能力与外部知识检索系统相结合,以生成更精准且符合上下文的回答。将RAG整合到QSP中可以帮助研究人员提升模型开发质量、改进决策流程,并推动个性化医疗的实施。RAG能够动态访问最新的科学文献、数据库和临床指南,使QSP模型持续获取最新研究成果。通过整合多样化的数据源,这种方法有助于验证和优化机制模型,从而提升QSP仿真的稳健性与可靠性。利用患者特异性数据与实时信息检索,基于RAG增强的QSP模型能够模拟个体化的治疗反应。这一方法支持数字孪生(DTs)的构建,即反映特定患者生理状态的计算模型,用于预测治疗结果并优化治疗策略。将RAG整合进QSP框架,还有助于识别潜在药物靶点、理解复杂生物通路以及预测不良反应。这种综合方法在药物开发全过程,从靶点识别到临床试验设计中提升决策的科学性与效率。
尽管RAG与QSP的整合具有显著优势,但仍存在挑战,包括数据质量保证、计算复杂性管理以及监管方面的考量。未来研究应重点关注制定RAG在QSP中实施的标准化协议,并探索其在不同治疗领域中的应用。
应对AI-QSP整合中的挑战与局限
首要问题之一是DNNs等复杂机器学习模型常被视为“黑箱”,其内部机理难以解释,而机制可解释性正是QSP的核心特征。为提升可解释性,研究者引入了SHapley Additive exPlanations(SHAP)等解释工具,并探索mechanistic-ML混合模型的构建,这些方法在保持预测精度的同时,提升了模型透明度。
另一大挑战是如何保证多源数据的质量与一致性。实验数据中的不准确性或偏差可能在AI驱动的模型中被放大,从而导致预测结果不可靠。此外,基因组学、蛋白质组学、临床和影像等多模态数据的整合,仍需依赖尚在发展的复杂预处理、标准化和数据融合策略。
监管挑战同样不可忽视。尽管QSP模型在监管领域的接受度逐渐提升,但引入AI组件的模型必须经过严格的有效性与可靠性验证,才能在临床研发决策中获得认可。美国FDA等监管机构尤其关注AI生成模型的可解释性、数据质量与偏差问题,并强调制定明确的验证标准以确保患者安全与模型稳健性。与此同时,QSP模型出版的标准化协议也在制定中,以解决可重复性问题。
未来展望与新兴趋势
展望未来,AI与QSP的整合有望随着计算能力的提升、更丰富的数据库以及更先进的机器学习算法而不断发展。一个重要趋势是构建数字孪生平台,将机制性QSP模型与患者特异性数据结合,用于模拟个体化的疾病进程并预测个性化的药物反应。这类虚拟患者模型能够支持精准医疗中的实时临床决策,并为基于持续模型更新的自适应临床试验设计提供可能。
强化学习和元学习方法同样具有潜力,它们可以通过模拟环境-患者交互,不断优化治疗策略并动态调整给药方案。同时,可解释人工智能技术的进步将有助于弥合高性能预测与机制理解之间的差距,确保AI增强的QSP模型在临床应用中既精准又透明。
此外,学术界、产业界与监管机构的跨领域协作正推动标准化QSP建模流程的建立,并将AI组件纳入其中,从而加快从临床前研究到虚拟临床试验的学习周期,最终改善患者治疗结局。在这一协作生态中,配备版本控制与符合FAIR原则的数据集的模型共享平台与存储库,将在确保AI驱动的研究成果能够快速传播与验证方面发挥关键作用。
总结
AI技术与机制性QSP建模的协同整合,为连接体外、体内与临床数据提供了一个极具前景的框架,最终能够提升药物疗效与安全性的预测能力,并在整个药物开发周期中支持决策。
尽管在数据质量、模型透明度与监管验证方面仍存在挑战,但AI的持续进步以及利益相关方之间的协作,有望进一步优化这些方法论,推动构建高效、可临床转化的QSP模型。随着数字孪生技术、自适应试验设计以及患者特异性建模的不断发展,AI与QSP的融合有望在应对现代治疗开发复杂性方面发挥关键作用,从而降低研发失败率并加速个性化医疗的落地。药理建模的未来将依赖于混合范式:既结合QSP的可解释性,又具备AI的计算效率与模式识别能力,从而创建能够适应生物医学研究不断演变格局的综合框架。
通过持续优化这些整合方法,并以创新的计算策略应对当前挑战,制药研发界有望构建更稳健、可扩展且可解释的QSP模型,加速治疗创新,提升精准医疗时代的患者疗效。
参考链接:
https://doi.org/10.1016/j.drudis.2025.104448
--------- End ---------
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢