01. 靶点发现
1949年研究人员首次在酵母中发现乙醛脱氢酶ALDH的催化活性,但人类ALDH基因的明确分类直至1980年代才完成。1988年,日本学者确定ALDH2基因多态性(rs671突变),揭示了东亚人“喝酒脸红”的遗传根源——该突变导致酶活性丧失,全球约5.6亿人携带。在人体内,位于肝脏的ALDH2主要负责将饮酒产生的乙醛氧化成乙酸,以及代谢氧化应激脂质过氧化产生的活性醛类等。ALDH2 rs671是我国人群中最为常见的功能性遗传基因变异位点之一,该位点变异后ALDH2酶活性显著下降,导致喝酒后脸红,还会显著增加心血管疾病风险。
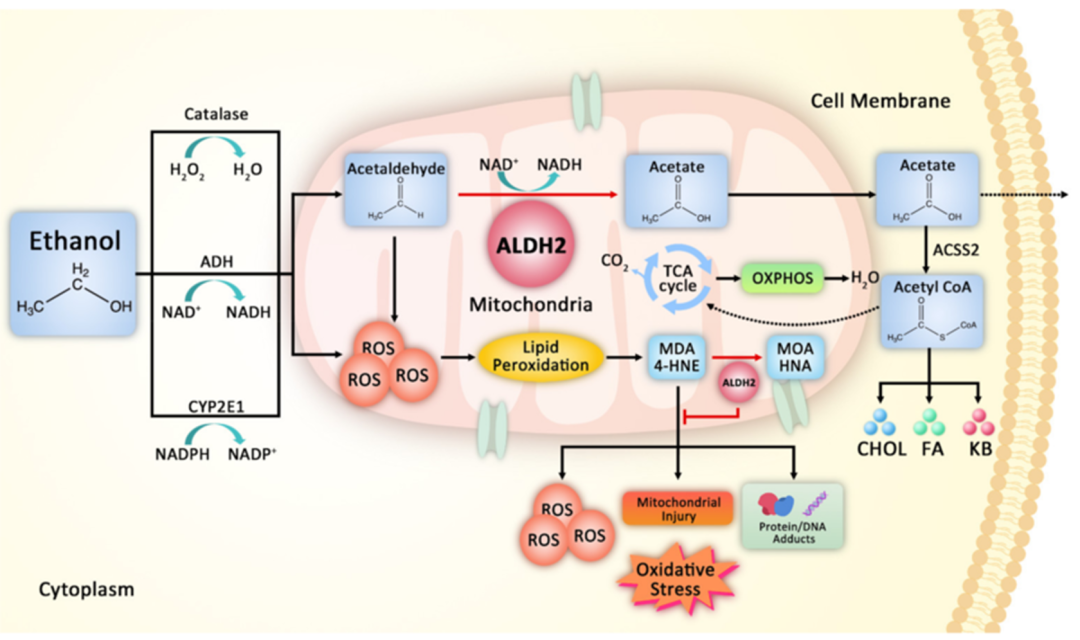
图1. ALDH2 催化乙醇代谢中醛代谢的途径
青云瑞晶已完成ALDH蛋白靶点的蛋白表达和结构解析。基于这些实验条件和库存蛋白,可以将项目的交付时间缩短至1-2个月,并确保项目的成功交付。
*蛋白表达和结构解析结果详见文末!
02. 功能简介
ALDH(尤其是线粒体型ALDH2)将乙醇代谢产生的有毒乙醛氧化为无毒的乙酸,防止乙醛蓄积引发DNA损伤、肝硬化和致癌风险。ALDH同时负责细胞的内源性醛类如脂质过氧化产物4-羟基壬烯醛(4-HNE)的清除,减少活性醛对蛋白质、核酸的毒性修饰,保护细胞免受氧化应激损伤,维持细胞稳态。
除乙醛代谢的核心功能外,ALDH同时拥有生理调节功能。ALDH1A家族催化视黄醛氧化为视黄酸,调控胚胎发育、细胞分化和器官形成,尤其在神经系统和心脏发育中发挥关键作用。ALDH代谢乙醛生成的乙酸也会进入三羧酸循环供能,参与细胞能量代谢。在脂代谢过程中ALDH促进高密度脂蛋白(HDL)介导的胆固醇逆向转运。线粒体中,ALDH2可以保护线粒体膜完整性,维持ATP合成效率,对抗缺血再灌注损伤[1]。在癌症与肿瘤调控领域,ALDH1高活性是乳腺癌、白血病等肿瘤干细胞的标志,与化疗耐药性和复发风险正相关[2]。免疫调节与抗病毒相关研究表明,ALDH1B1通过聚集线粒体蛋白MAVS,增强RIG-I受体介导的抗病毒信号通路,促进干扰素产生,抑制甲型流感、登革热等RNA病毒复制[3]。
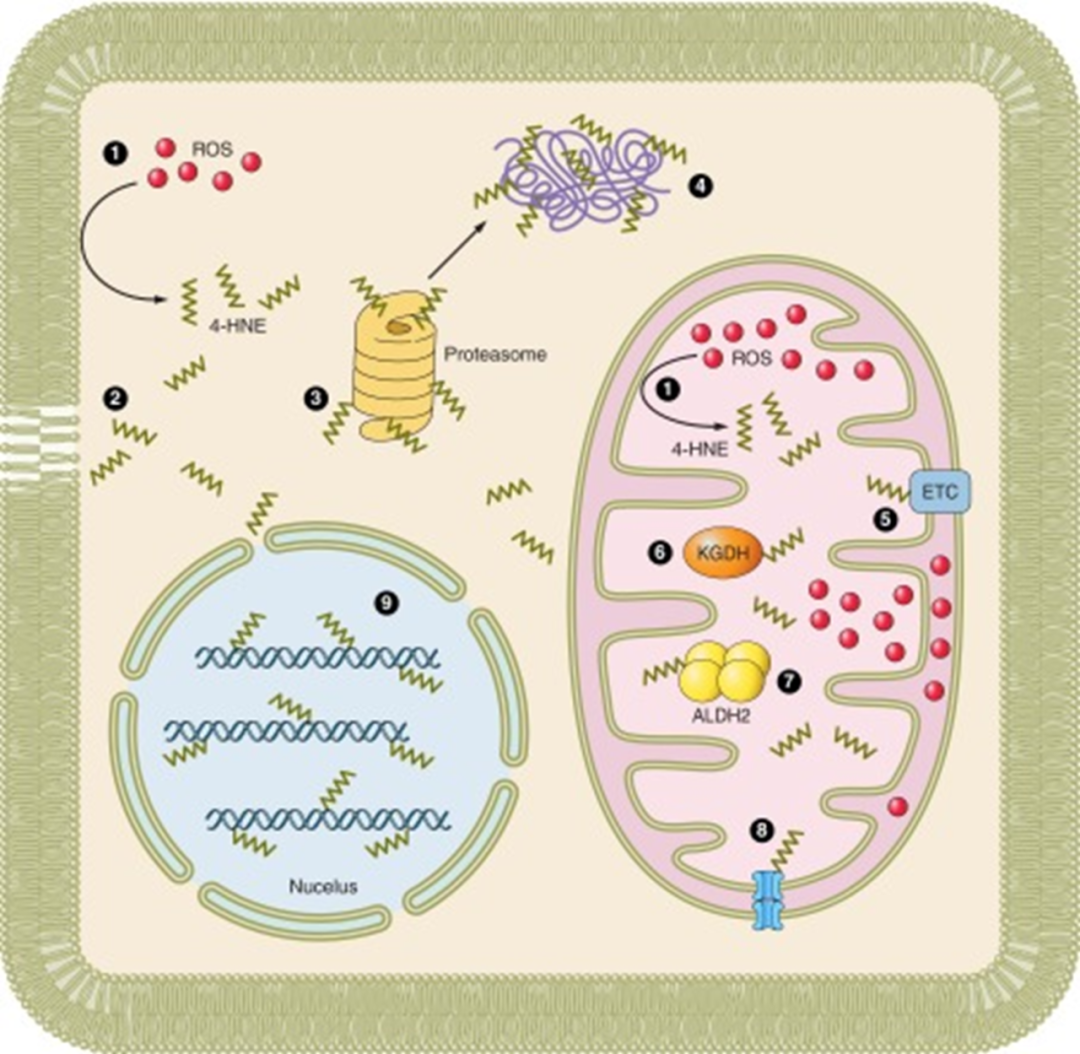
图2. 氧化应激导致醛类物质如4-羟基壬烯醛(4-HNE)的积累会促进细胞死亡
03. 结构特征
ALDH家族成员均具有经典的三结构域折叠模式,包含:1.NAD⁺结合域:负责结合辅酶NAD⁺(烟酰胺腺嘌呤二核苷酸),含保守的Rossmann折叠基序。2.催化结构域:核心区域含活性中心,由半胱氨酸、谷氨酸等关键残基构成。3. 寡聚化结构域:介导亚基间相互作用,维持四聚体稳定性。其单体分子量约56 kDa,功能性酶通常以同源四聚体形式存在(如ALDH2、ALDH6A1),形成"风扇状"空间构象。
ALDH家族中线粒体型的ALDH2通常定位于线粒体基质,其结构主要为四聚体,占人体ALDH总活性80%,含跨膜靶向序列。胞质型的ALDH1A1通常定位于细胞质,参与视黄酸合成,其催化结构域含特殊疏水通道。ALDH3A1定位于角膜上皮,兼具晶状体蛋白功能,可以抵抗紫外线氧化损伤。
ALDH的关键催化残基包括:半胱氨酸-302(Cys302),位于催化结构域,作为亲核试剂直接攻击醛基底物的羰基碳,形成硫酯中间体。谷氨酸-268(Glu268),负责激活Cys302的硫醇基团,促进其去质子化,Glu268突变后酶活性完全丧失。部分ALDH(如ALDH1)含锌离子,负责稳定活性中心构象并辅助底物定向。ALDH2的rs671突变为第12号外显子G→A点突变,导致第487位谷氨酸(Glu)突变为赖氨酸(Lys),该突变改变NAD⁺结合口袋的电荷分布,破坏四聚体稳定性导致突变亚基无法正常组装,降低辅酶亲和力100倍以上,酶活性丧失90%以上。2024年清华团队解析ALDH6A1的3.2Å冷冻电镜结构,首次捕捉到NAD⁺结合后的构象变化:催化结构域发生15°旋转,暴露出Cys302活性位点。
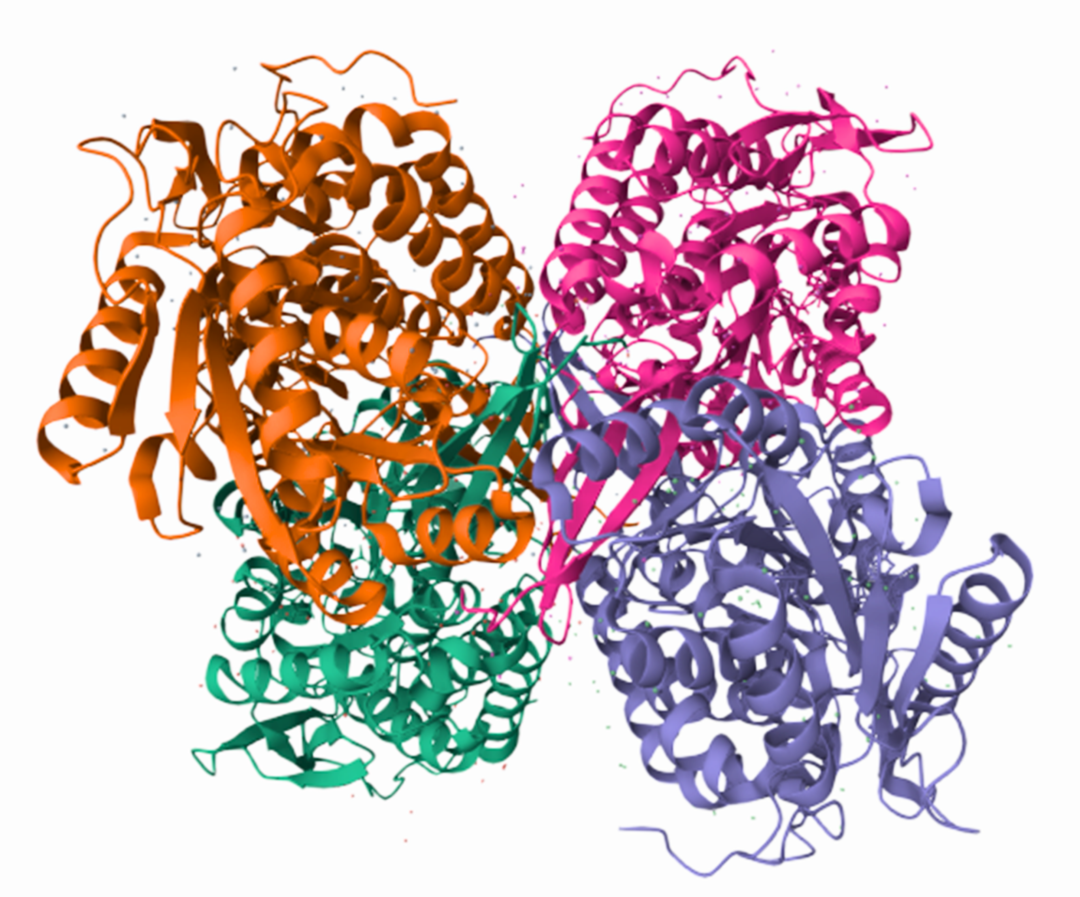
图3 人源AHDH2解析结构
04. 靶点药物
目前ALDH靶向药物正从单一解毒功能向疾病修饰治疗跨越。其药物研发主要集中在化学类药物领域,目前ALDH靶点药物类型可分为以下几种:
1. ALDH激活剂:修复突变酶活性
Alda系列化合物(心血管保护)
-
Alda-1:首个小分子变构激活剂,通过填充ALDH2*2突变体(Glu487Lys)的四聚体界面空腔,恢复酶活性70-90%。
-
Alda-341(口服改良型):2025年II期临床显示,急性心梗患者24小时心肌坏死面积减少32%。
Mirivadelgat(肺动脉高压治疗)
-
逸达生物研发的ALDH刺激剂,2025年进入临床II期,通过增强ALDH介导的NO信号通路改善血管重塑。
2. ALDH抑制剂:抗癌与代谢疾病干预
靶向ALDH1A1(克服肿瘤耐药)
-
新型小分子抑制剂:选择性抑制ALDH1A1酶活性,阻断其介导的视黄酸合成与脂滴形成,使KRAS突变癌细胞对靶向药(如Sotorasib)敏感性提升4倍。
-
关键机制:通过降低细胞内pH值,抑制CREB1/GPX4通路,增强铁死亡。
GS-548351(尼古丁依赖)
-
吉利德研发的ALDH抑制剂,因脱靶效应终止临床,提示亚型选择性设计挑战
3. 基因疗法与RNA干预
Lefelsiran sodium(慢性病治疗)
-
siRNA药物(Dicerna/诺和诺德),靶向ALDH mRNA,临床I期用于代谢性疾病,通过肝定向递送降低酶表达。
ARO-INHBE(肥胖治疗)
-
Arrowhead公司RNAi疗法,沉默INHBE基因并间接调控ALDH通路,动物模型中减少脂肪量并改善葡萄糖稳态
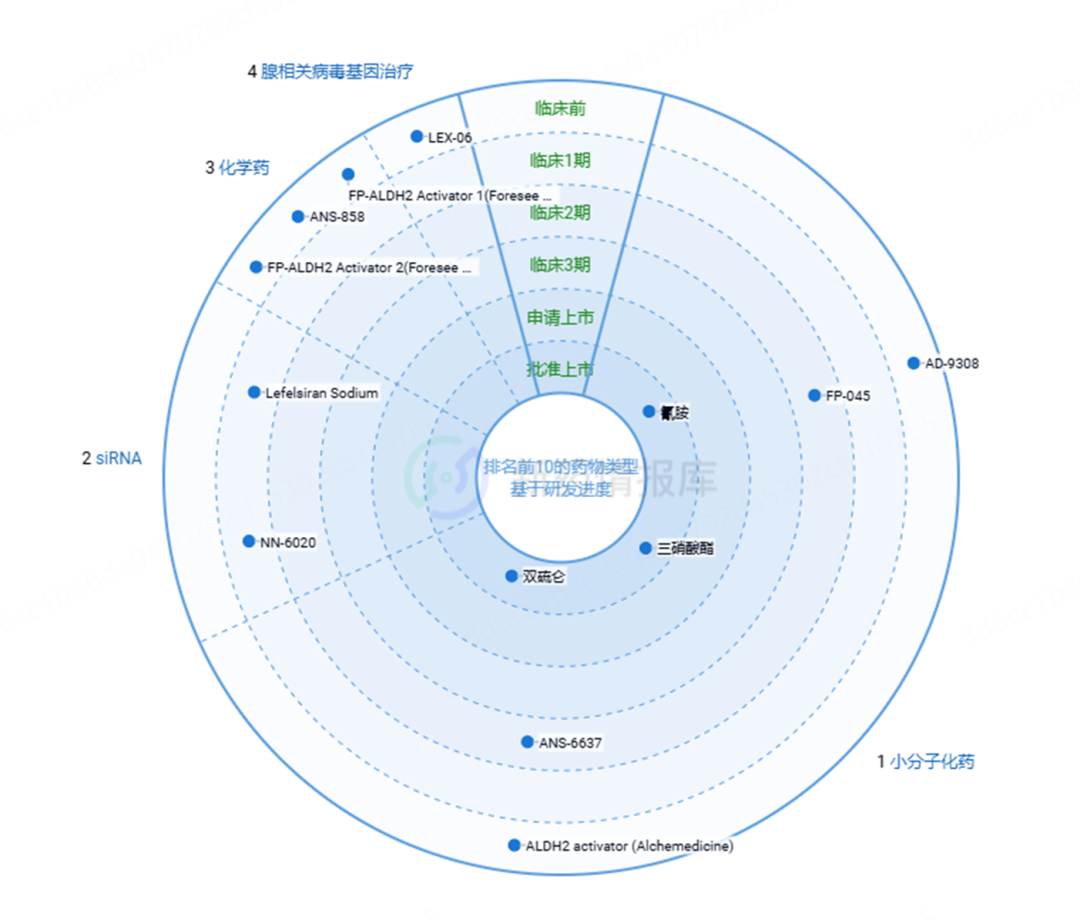
目前在研的药物情况统计如下:
实验结果展示
青云瑞晶已完成ALDH蛋白靶点的蛋白表达和结构解析。基于这些实验条件和库存蛋白,可以将项目的交付时间缩短至1-2个月,并确保项目的成功交付。


备注:部分实验结果涉及客户项目信息,不予展示。
▶ 表达纯化结果(周期:现货或者4周)
*客户纯化结果据保密协议无法展示
来源doi: 10.1007/s00253-008-1608-x
▶ 结晶和结构解析(周期:1-2周)

*客户结果据保密协议无法展示,替换为相似分子量自研MALT1蛋白
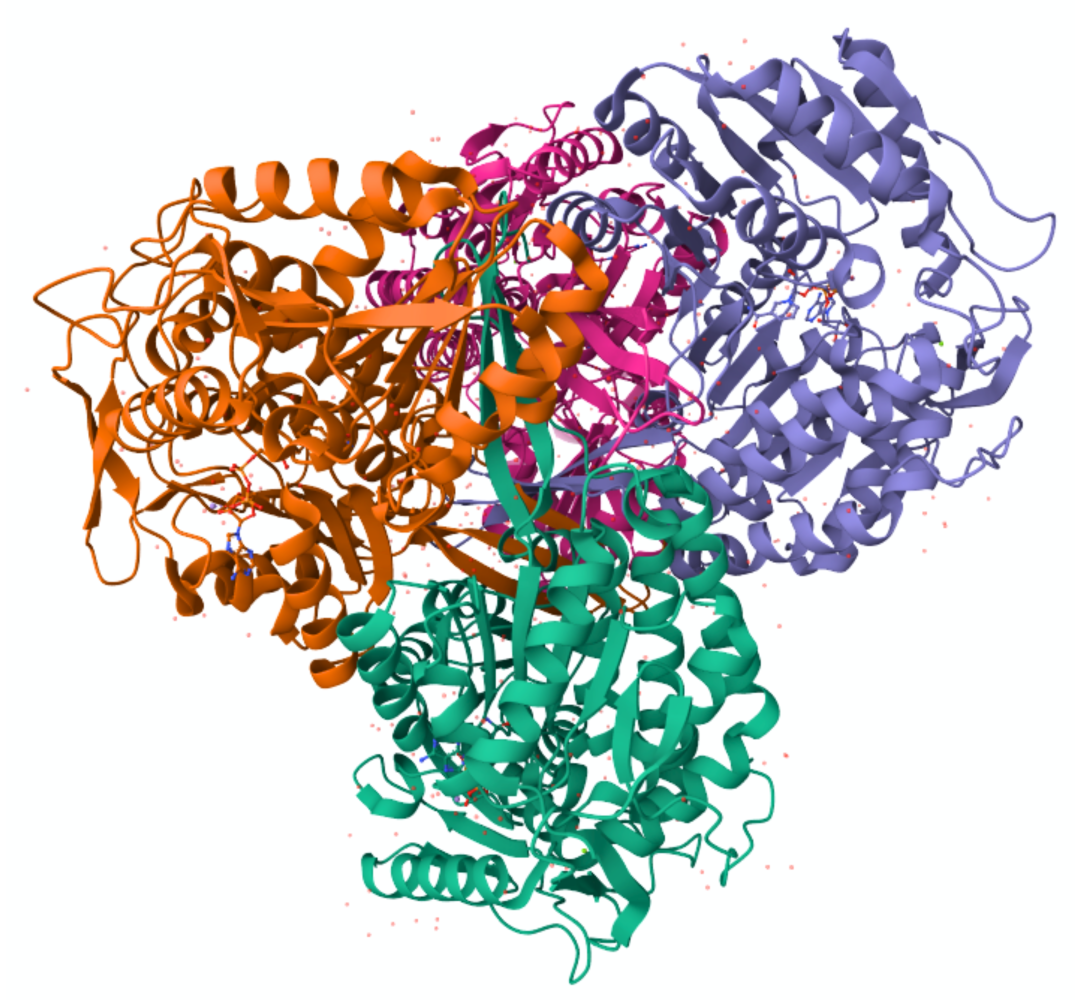
人源ALDH2结构示意图
「青云瑞晶」提供专业的结构解析技术服务,自拥有单晶X射线衍射(XRD)、冷冻电镜单颗粒法(CryoEM-SPA)、MicroED 三种结构解析技术平台,根据蛋白质的不同性质,提供不同的解决方案,结合精良高端的实验设备、经验丰富的高学历科研团队,为您提供从蛋白表达开始的一站式结构解析服务,灵活多样化满足您的多种科研及工业界需求。

★ 参考文献
[1] Chen CH, Ferreira JC, Gross ER, Mochly-Rosen D. Targeting aldehyde dehydrogenase 2: new therapeutic opportunities. Physiol Rev. 2014 Jan;94(1):1-34. doi: 10.1152/physrev.00017.2013. PMID: 24382882; PMCID: PMC3929114.
[2] Clark DW, Palle K. Aldehyde dehydrogenases in cancer stem cells: potential as therapeutic targets. Ann Transl Med. 2016 Dec;4(24):518. doi: 10.21037/atm.2016.11.82. PMID: 28149880; PMCID: PMC5233526.
[3] Sun N, Cai Q, Zhang Y, Zhang RR, Jiang J, Yang H, Qin CF, Cheng G. The aldehyde dehydrogenase ALDH1B1 exerts antiviral effects through the aggregation of the adaptor MAVS. Sci Signal. 2024 Jan 9;17(818):eadf8016. doi: 10.1126/scisignal.adf8016. Epub 2024 Jan 9. PMID: 38194477.
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢