DRUGONE
蛋白质设计传统上聚焦于稳定低能态结构,确保其高丰度。然而,要实现动力学与动态特性的调控,还需要设计在状态转变中短暂存在的激发态。本研究提出一种通用方法,通过“诱导契合驱动力”构建结构受挫且带有张力的激发态,从而变构性地驱动蛋白质复合物的解离。利用晶体学、电电子共振光谱和动力学测量,研究人员证明引入激发态可使效应子诱导的解离速率提升高达 5,700 倍。该策略被用于快速生物传感器、动力学控制回路以及可在数秒内从受体解离的细胞因子模拟物,进而揭示白介素-2 信号的时间动力学。

蛋白质-蛋白质相互作用调控着大多数生物功能。高亲和力有助于在低浓度刺激下实现高效作用,而快速交换则能使系统灵敏响应环境变化。然而二者难以兼得,因为高亲和力通常伴随缓慢解离,而快速响应则依赖较高解离速率。在自然界中,部分体系展现了“促进性解离”现象:效应子与复合物结合,形成三元激发复合物,从而加速目标分子的释放。类似原理在 DNA 领域(如链置换反应)已广泛用于复杂功能的实现,但蛋白质体系中尚缺乏通用的可设计方法。研究人员因此提出,通过引入响应效应子的构象开关,将其与结合蛋白融合,以此在效应子结合时触发空间冲突并诱导目标分子快速解离,从而在动力学上实现精细调控。
方法
设计策略
研究人员选择了一个效应子响应构象开关(铰链蛋白)并与模型结合体融合。设计的思路是:在无效应子结合时,靶标正常结合;在效应子结合时,构象转变导致强烈空间冲突,形成张力三元复合物并触发靶标解离。为达到这一点,研究人员通过调整开关与结合体的融合几何结构,确保激发态的能量处于可行范围。
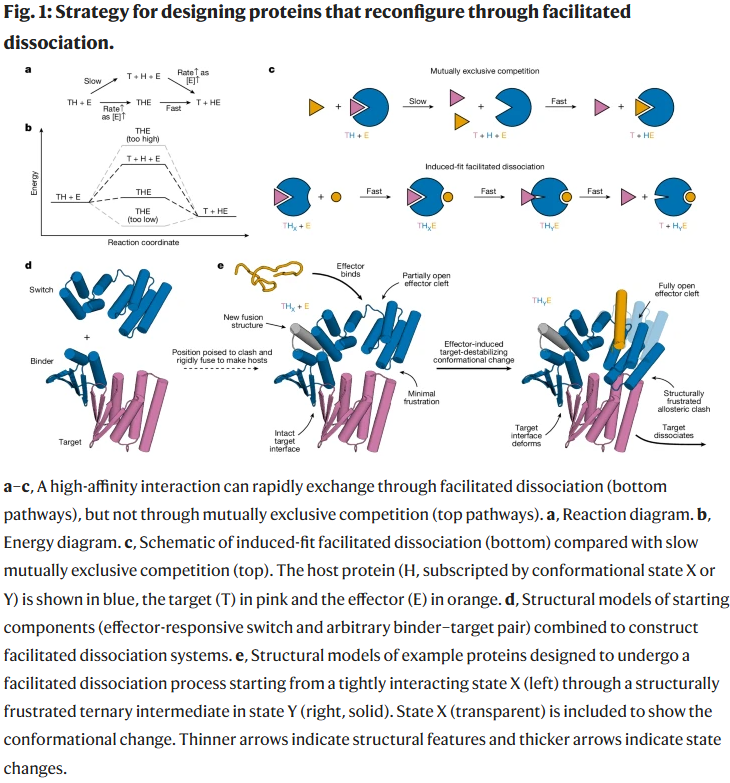
蛋白构建与筛选
研究人员合成了多个设计基因,并在大肠杆菌中表达纯化。通过表面等离子体共振(SPR)等方法测试结合与解离动力学,评估效应子诱导下的解离加速效果。部分设计(如 AS1)展现出显著的促进性解离效应。
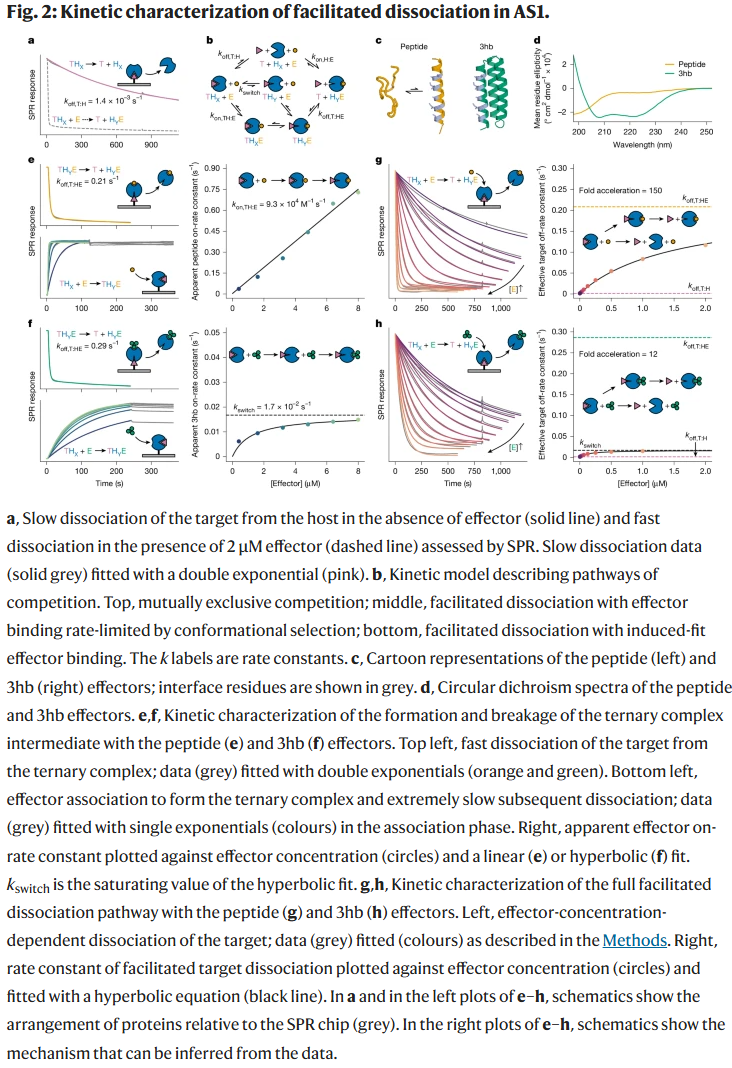
结构与动力学表征
研究人员利用晶体学、电电子共振(DEER)和分子动力学模拟表征了目标-宿主-效应子三元复合物的结构状态,揭示了解离过程中张力分布的动态特征。同时,通过调节融合结构的变形方向与程度,进一步优化了张力能量分布,从而提升了解离速率。
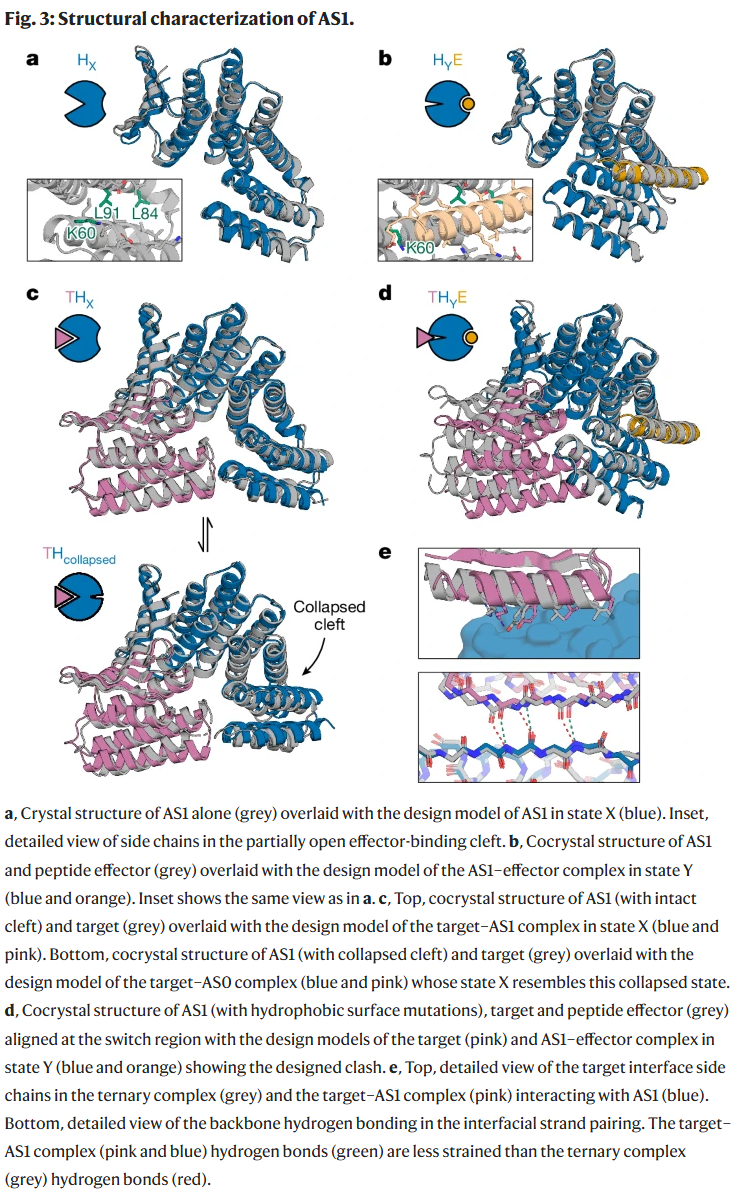
结果
促进性解离的动力学机制
AS1 系统验证了效应子结合可显著提升目标分子解离速率。灵活肽类效应子能通过诱导契合机制加速构象转变,而刚性效应子虽结合更紧密,却在速率提升上不如灵活效应子。晶体结构与模拟显示,三元复合物处于受挫张力状态,目标蛋白界面发生扭曲与解体。
解离速率的调控
研究人员通过修改开关与结合体的相对构象,成功改变了三元复合物的张力大小与方向。不同设计展现了数百到数千倍的解离加速效果,其中 AS117 的效应子诱导下目标解离速率提升达 2,400 倍。
应用场景
链式反应电路:通过设计串联的目标-效应子融合物,研究人员实现了刺激触发的快速级联反应。
可控分子工具:在裂解型荧光素酶体系中,促进性解离加速了复合物断裂,实现了快速的信号开关。
快速生物传感器:基于 SARS-CoV-2 RBD 的传感器显示响应时间仅 30 秒,比传统设计快约 70 倍。
IL-2 信号的时序调控:研究人员设计了可快速解离的 IL-2 模拟物(ASNeo2)。在效应子作用下,其与受体的结合在数秒内终止,从而精确调控 IL-2 信号。实验结果表明,瞬时刺激即可提供细胞存活信号,而持续刺激则驱动细胞增殖。
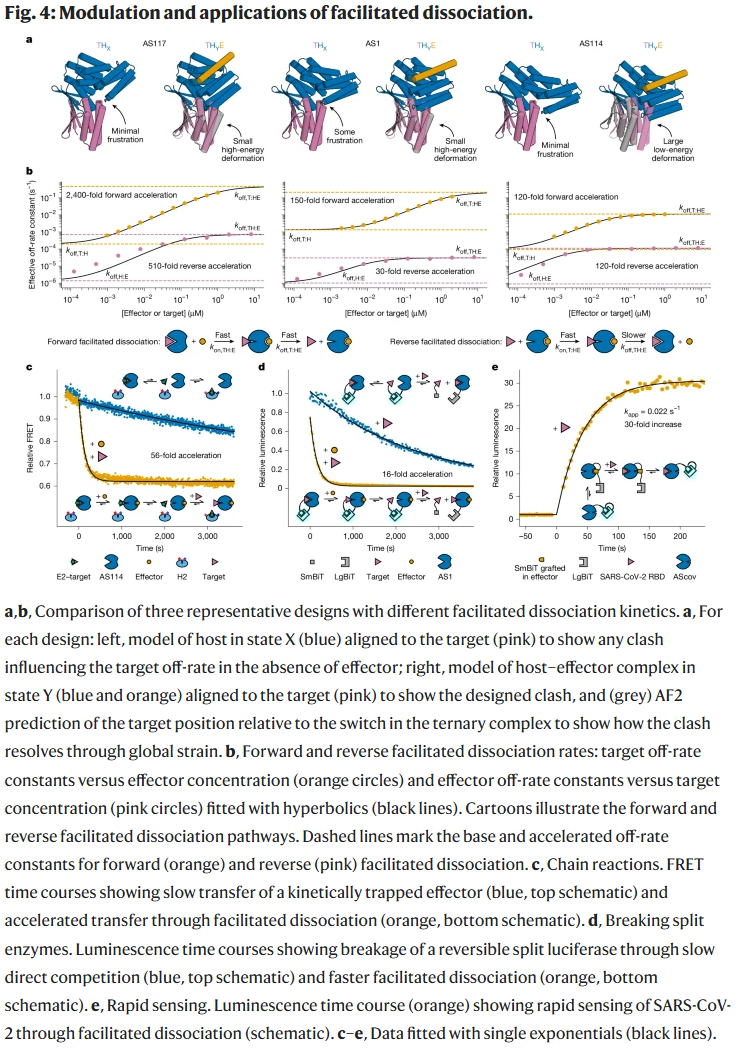
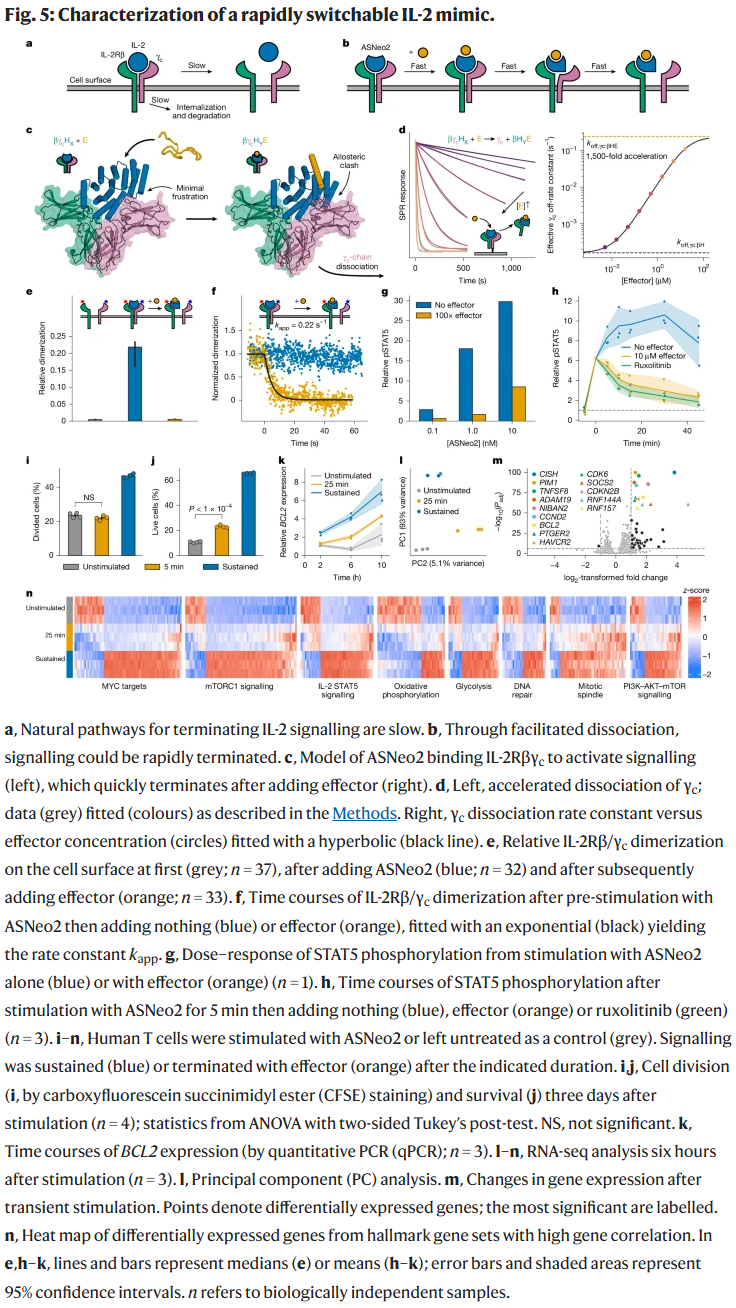
讨论与结论
研究人员展示了通过引入激发态来实现蛋白质体系动力学调控的可行性。促进性解离提供了比传统竞争机制更高效的解离方式,并可通过调节张力能量进行精细控制。灵活效应子的诱导契合机制在速率提升中尤为关键,而刚性效应子效果有限。
这一方法不仅在基础生物学中揭示了细胞因子信号时序的关键作用,还在合成生物学和治疗学上具有应用潜力。例如,可用于设计快速响应的细胞因子药物,只在局部发挥作用,避免系统性副作用。更广泛地说,这一策略为构建复杂、类生命的动态蛋白质机器奠定了基础。
整理 | DrugOne团队
参考资料
Broerman, A.J., Pollmann, C., Zhao, Y. et al. Design of facilitated dissociation enables timing of cytokine signalling. Nature (2025).
https://doi.org/10.1038/s41586-025-09549-z

内容为【DrugOne】公众号原创|转载请注明来源
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢