亮点
机器学习正彻底改变药物早期发现阶段的吸收、分布、代谢、排泄与毒性(ADMET)预测。
图神经网络、集成学习和多任务模型可提升预测准确性与可扩展性。
多模态数据整合可增强模型稳健性与临床关联性。
可解释性仍是核心挑战,新解决方案正助力提升模型透明度。
机器学习(ML)驱动的ADMET预测可加速先导化合物优化,降低药物后期研发失败率。
摘要
ADMET评估是决定药物候选化合物临床成功的基础。传统实验方法虽可靠,但资源消耗大;而传统计算模型则缺乏稳健性与泛化性。近年来,ML通过解析复杂的结构 - 性质关系,为 ADMET 预测带来变革,提供了可扩展、高效的替代方案。本文系统探讨了当前最先进的方法(包括图神经网络、集成学习和多任务框架),以及新兴的多模态数据整合策略与算法优化方法,旨在提升预测准确性与临床转化关联性。通过降低药物后期研发失败率、支持临床前决策、加速更安全有效的治疗药物研发,机器学习驱动的 ADMET 预测充分体现了人工智能在重塑现代药物发现与研发中的变革性作用。
药物化合物的ADMET预测
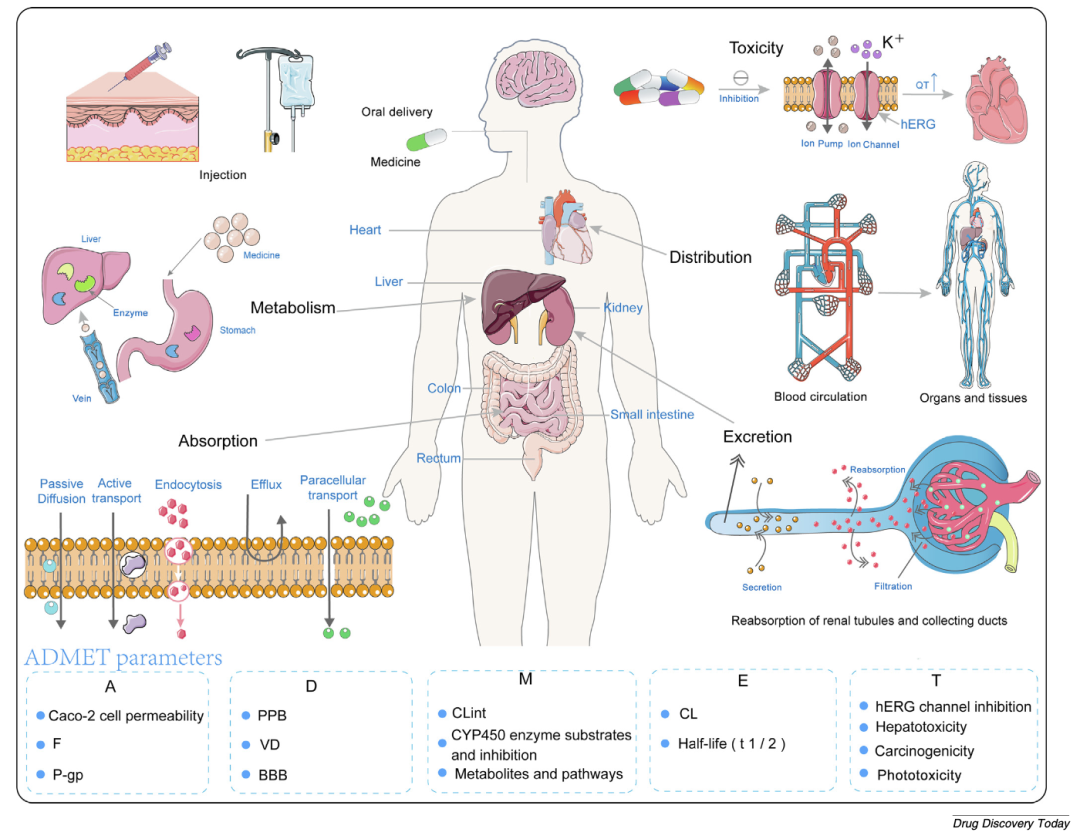
图1 ADMET跨器官动态过程机制分析
基于胃肠道渗透率、全身循环分布、肝脏首过代谢、肾清除率和hERG通道抑制的QT间期延长多维度模型。
ADMET建模中的机器学习方法
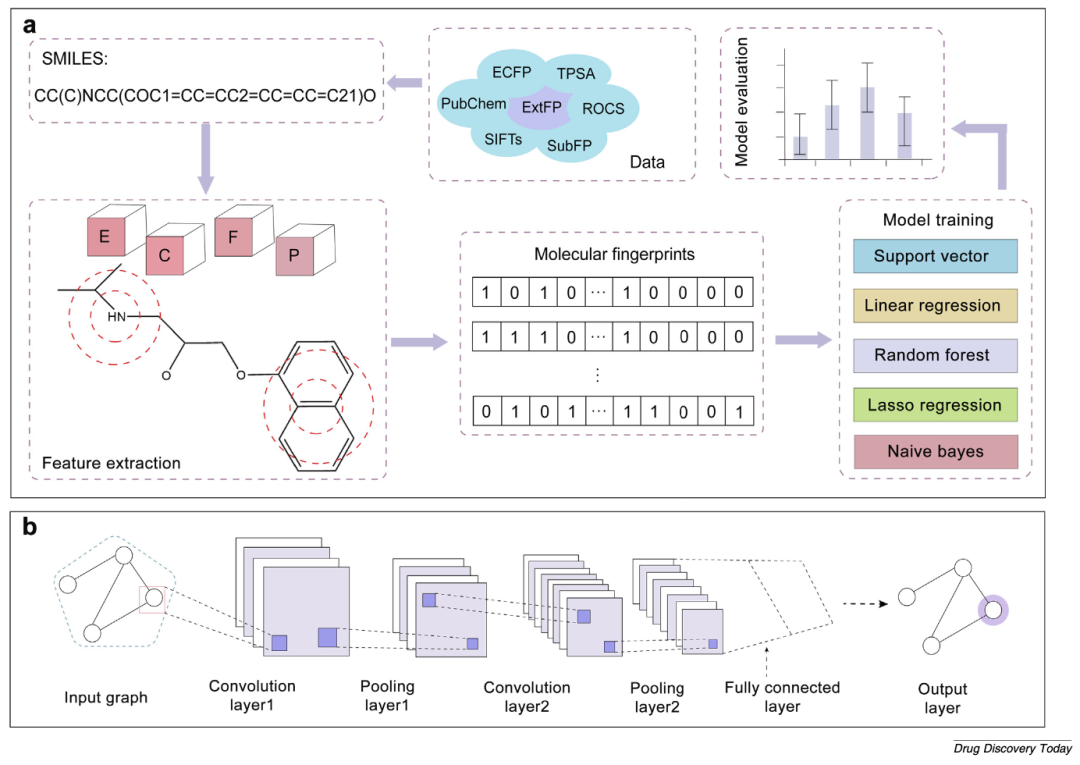
图2
(a)基于分子指纹的ADMET预测流程图;
(b)基于分子图卷积神经网络(CNN)的ADMET建模框架
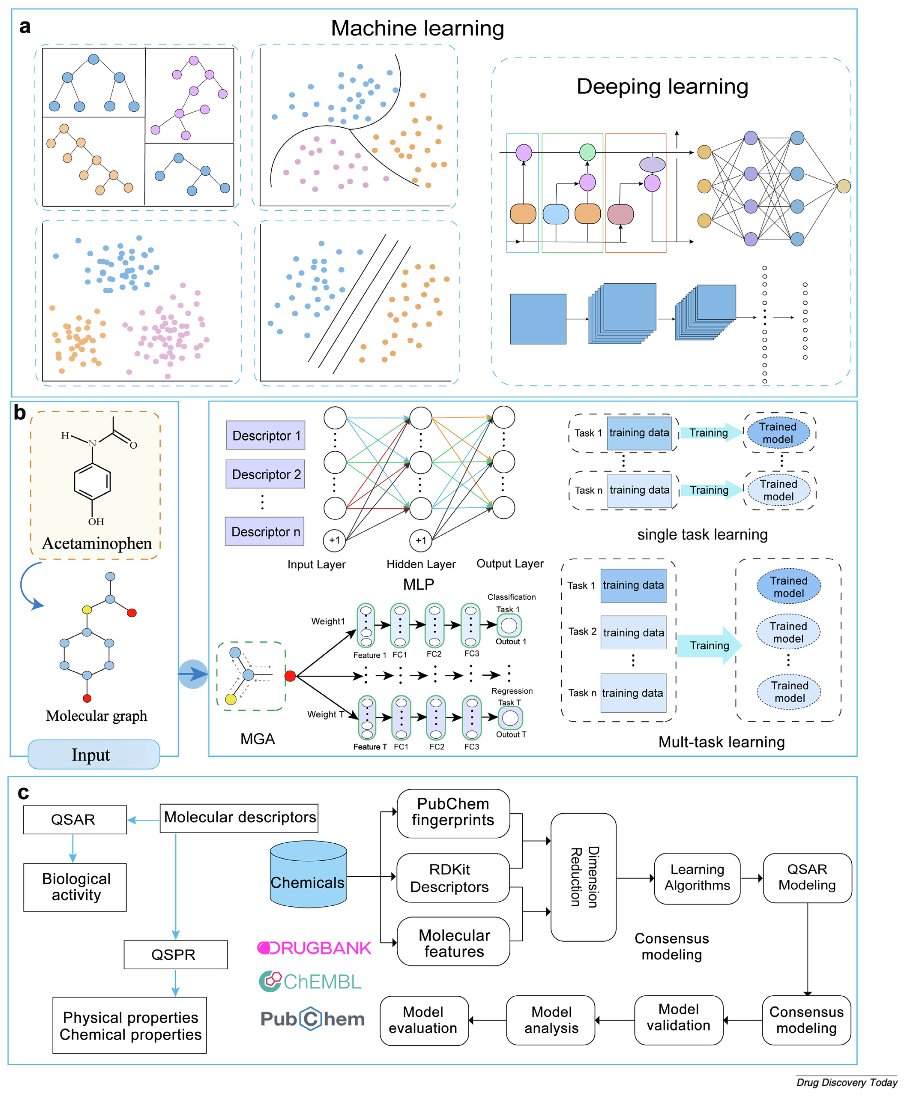
图3
(a)ADMET 预测与药物发现中常用的部分机器学习(ML)和深度学习(DL)算法概述;
(b)用于分子性质预测的多任务图注意力与多层感知器框架示意图;
(c)化学数据分析的定量结构-活性关系(QSAR)/定量结构-性质关系(QSPR)建模详细流程图
表1 ADMET预测工具
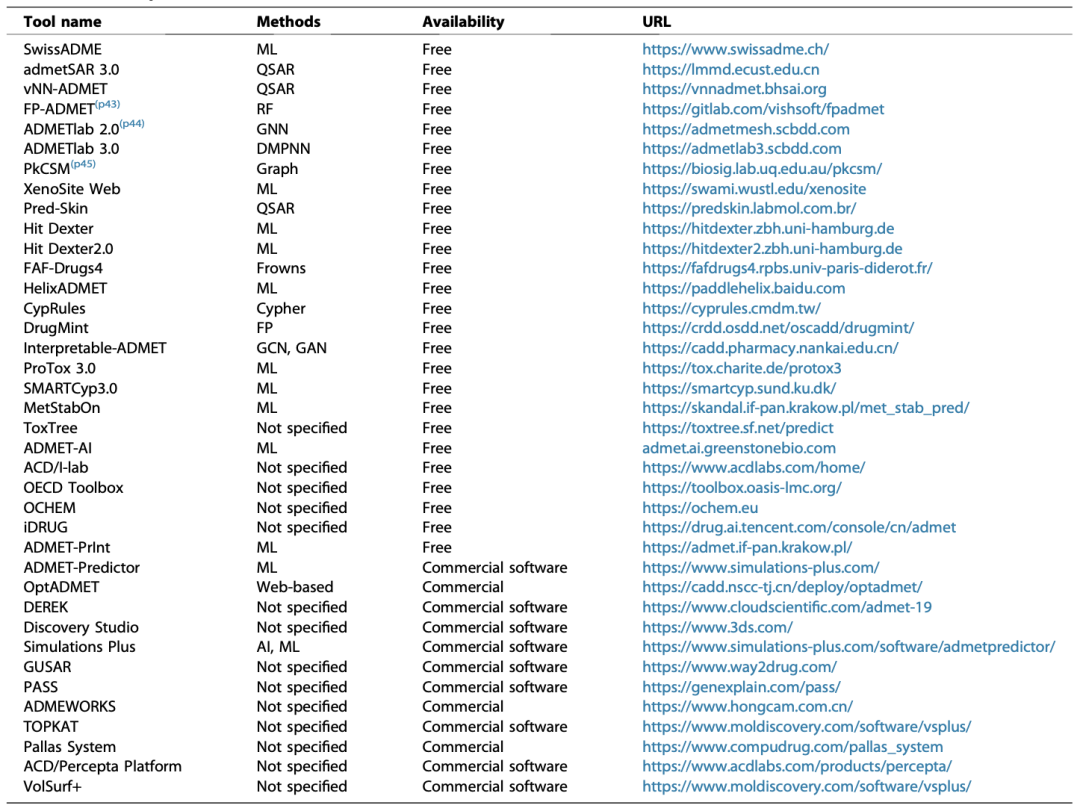
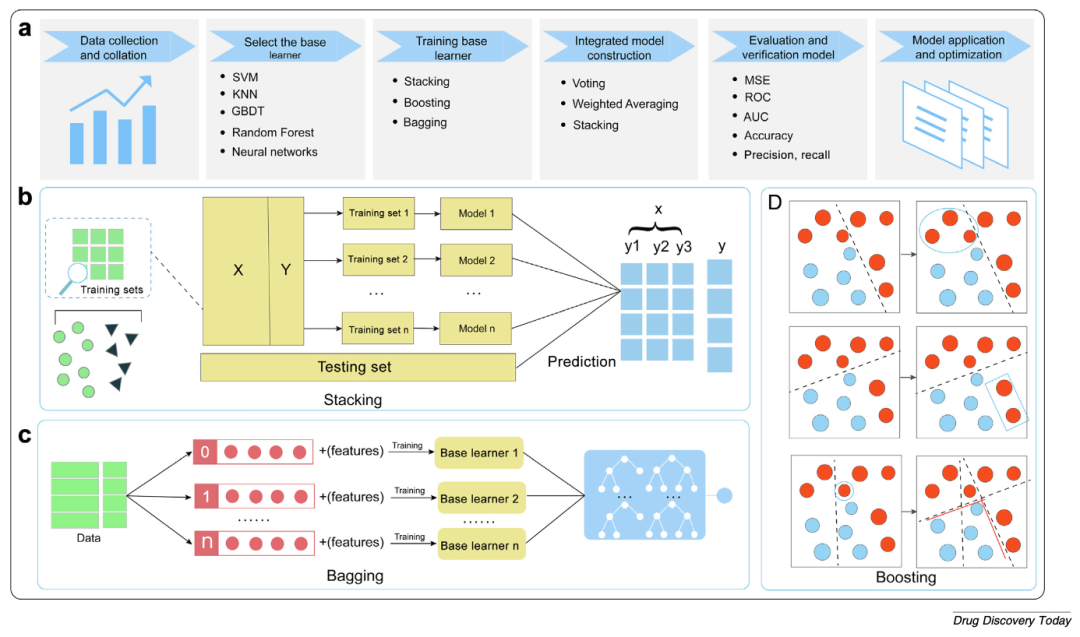
图4 基于集成学习的ADMET预测方法框架
(a)集成学习完整流程;
(b)堆叠(Stacking)架构;
(c)袋装(Bagging)架构;
(d)自适应提升(AdaBoost)
ADMET预测的挑战与机遇
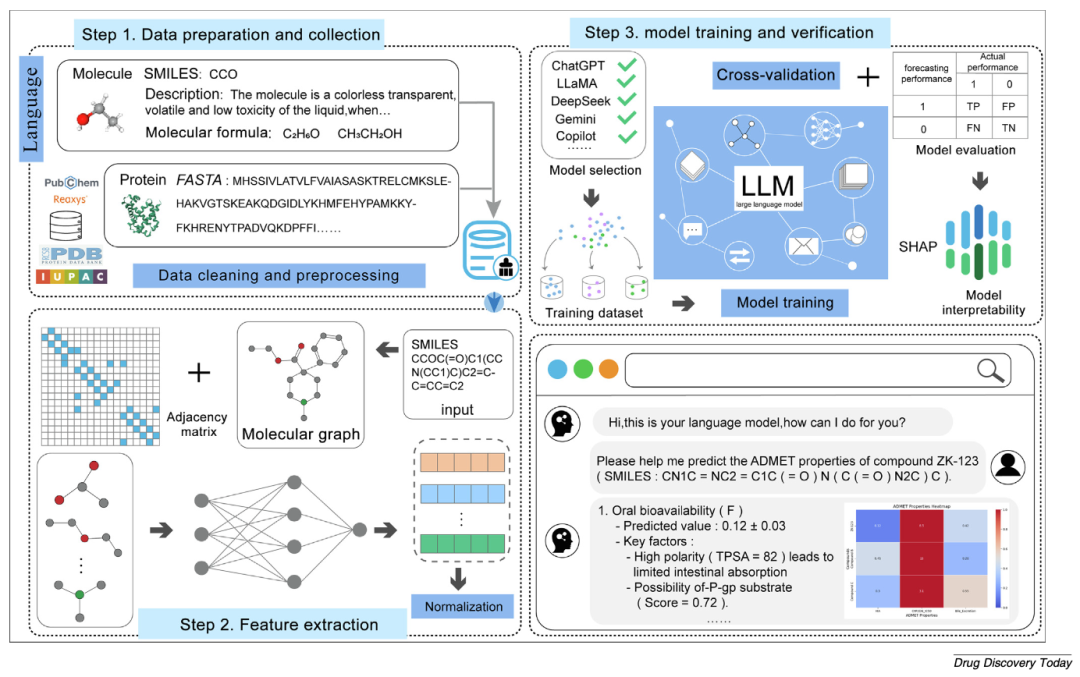
图5 大语言模型(LLM)驱动的药物性质预测图形框架
详细总结
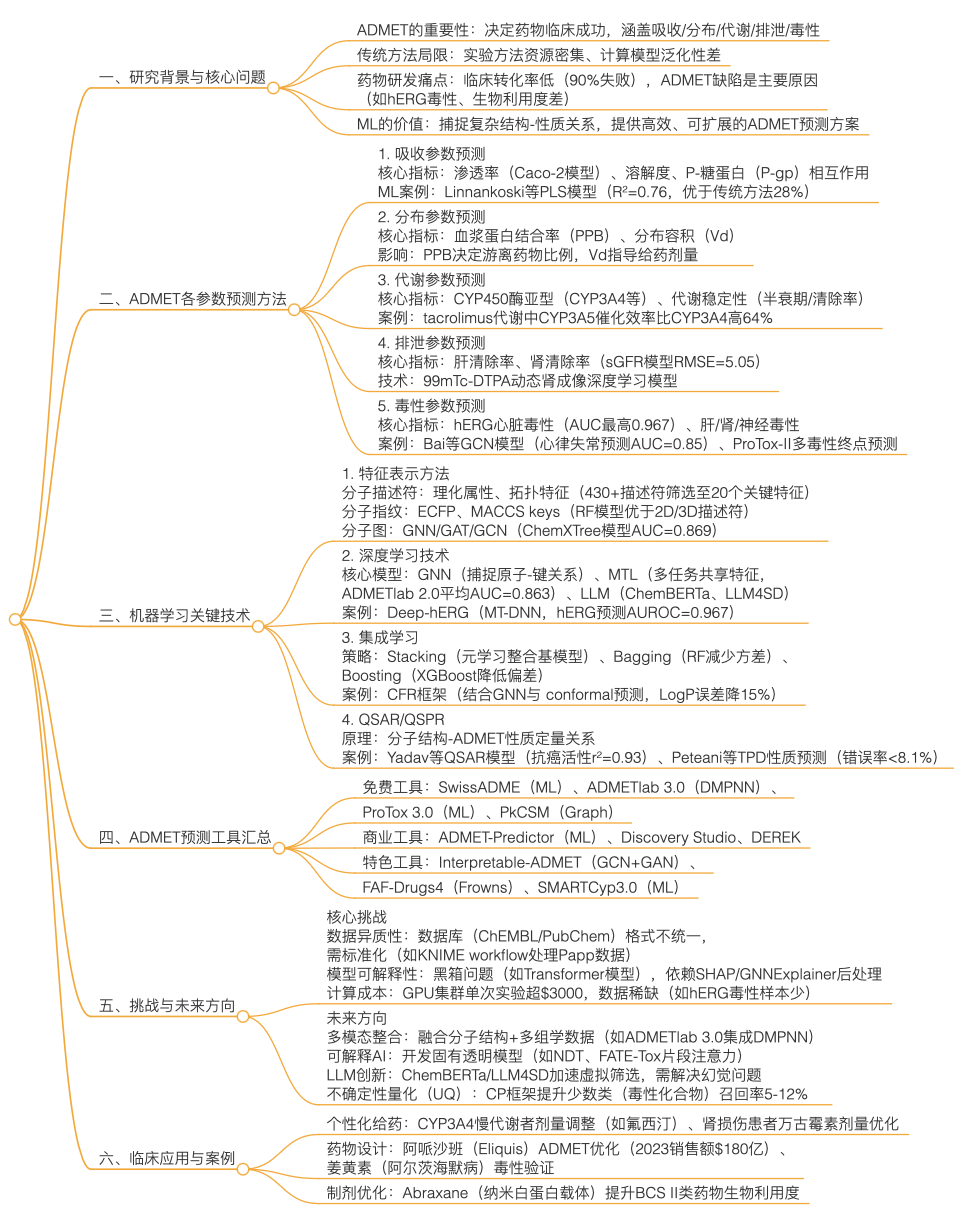
思维导图
吸收参数预测
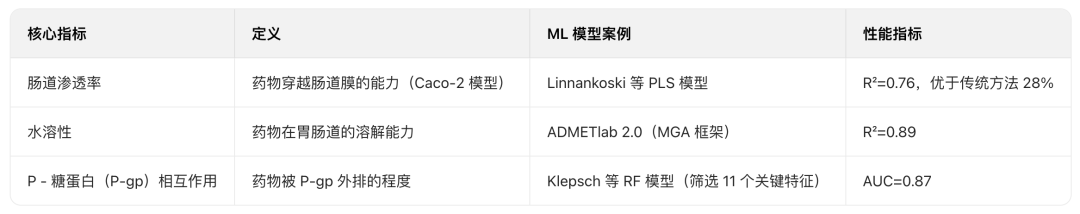
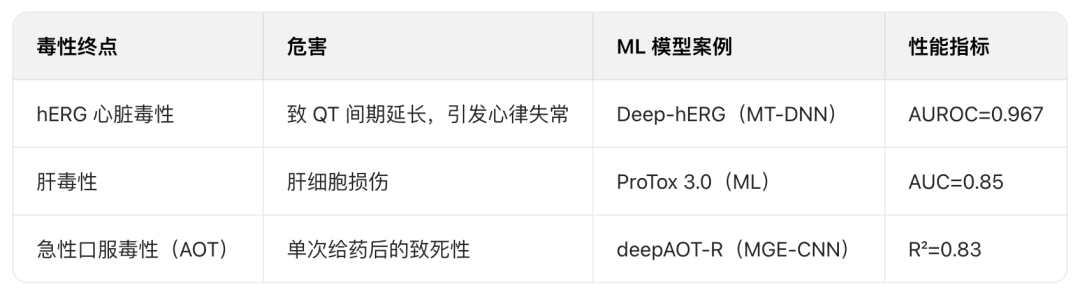
毒性参数预测
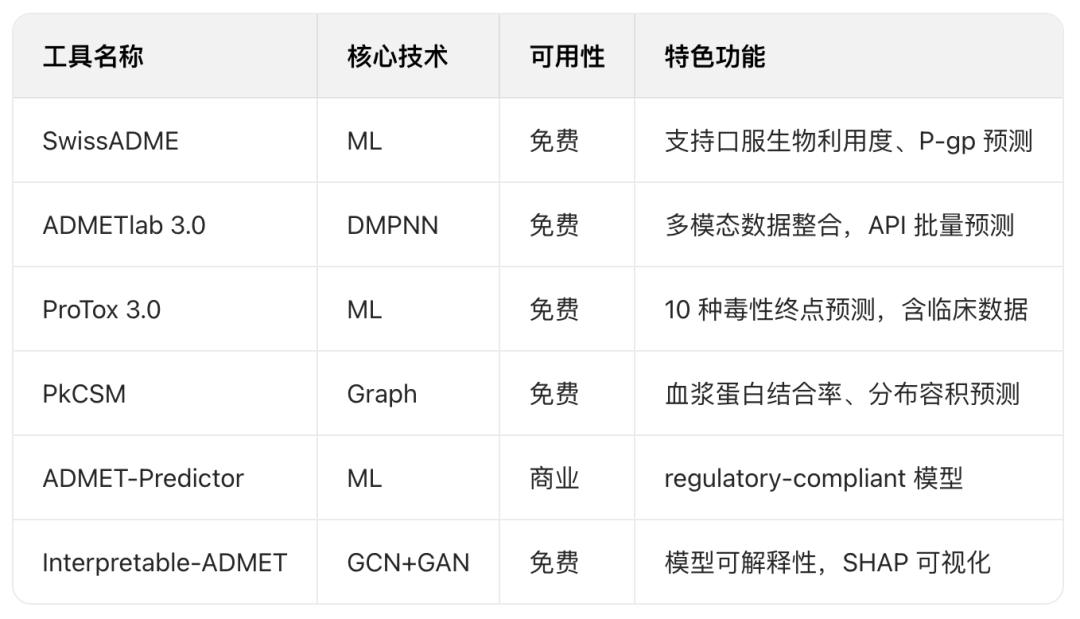
主流ADMET预测工具(部分)
综合性能最优的分子表示方法是分子图(基于GNN/GAT/GCN),具体对比如下:

参考
Drug Discov Today. 2025 Oct 4;30(11):104487. doi: 10.1016/j.drudis.2025.104487. Bridging data and drug development: Machine learning approaches for next-generation ADMET prediction
注:AI辅助创作,如有错误欢迎指出。内容仅供参考,不构成任何建议。
End
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢