生物医药行业如何悄然重夺科学创新的未来
——为什么 OpenFold 3 代表了新的 Bio-AI 基础平台
AlphaFold 3 改变了科学,而 OpenFold 3 这样的平台改变了规则。本文探讨:生物医药行业如何悄然把“大公司的技术护城河”变成共享基础设施,以及为什么这种转变可能重新定义未来的生物智能。
从未想过,有一天计算化学会变成“主流话题”
在大多数人知道“计算化学”是什么之前,我就已经是这个行业的一员。那时没有 AI,也没有人会在药企研发路线图里认真写上“计算驱动”。我经历过 QSAR 的时代,也经历过分子动力学、自由能计算、虚拟筛选各自的繁荣起落。
这些技术都经历了类似轨迹:发表突破→早期小范围使用→几十年后才引发行业级震荡。
AlphaFold 打破了这一规律。它几乎是一夜之间,成为结构生物学和药物研发的改变者。
战略分岔点出现了
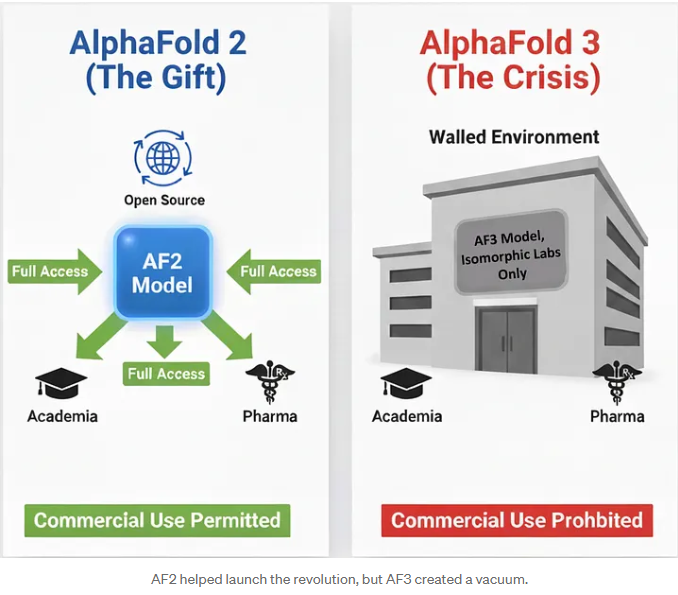
AlphaFold 2 是 Google 深度慷慨的礼物。它“基本解决了”蛋白折叠问题(这当然值得辩论,但这里姑且这么说),并开放了模型代码和权重,一举把结构生物学从“瓶颈学科”带入了“新时代”。
AlphaFold 3 的功能更进一步——它不仅预测蛋白结构,还预测蛋白与 DNA、RNA、小分子等的复合结构。尤其是“包含配体预测结构”的能力,使它成为药物研发流程中真正不可忽视的工具。
然而,“大分歧”从这里开始。
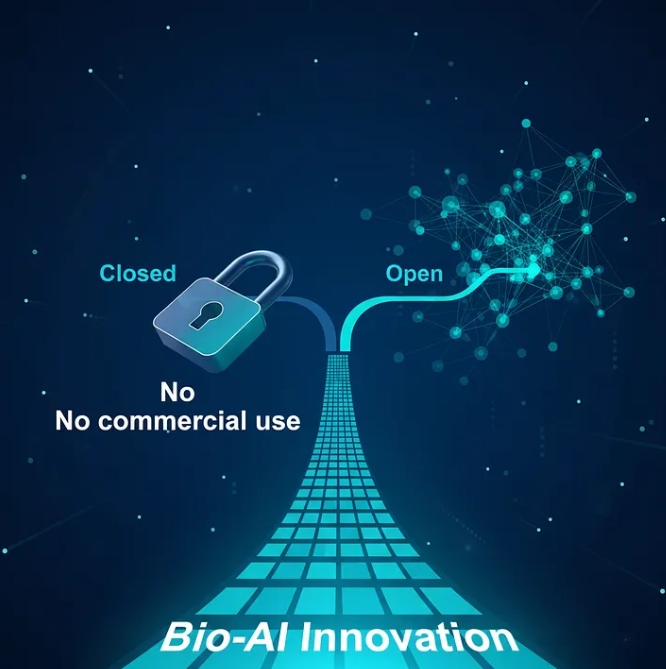
随着 Google 在 2021 年成立 Isomorphic Labs 商业化 AlphaFold 系列产品,AF3 在 2024 年发布时采用了“禁止所有商业使用”的许可证。换句话说,行业无法合法将其用于药物研发——这个模型本来正是为此而生的。
这不是简单的许可调整,而是科学治理模式的转变:
从“科学成果作为公共资源”,转向“科学成果作为商业平台”。
DeepMind 的贡献依然伟大,但生态系统的规则已经改变。
生物医药行业的“前竞争时代”觉醒
对此,生物医药行业的反应不是意识形态式的争论,而是务实的。经过短暂的愤怒与困惑后,一个前所未有的、跨巨头的组织出现了:
OpenFold Consortium(OpenFold 联盟)
这是一个拥有 BMS、强生、AbbVie、武田、诺和诺德、NVIDIA 等巨头成员的联盟——这些公司平时几乎不会在核心研发工具上合作。
加入 NVIDIA 的意义尤其巨大:整个计算基础设施供应链都在支持“开放共享模式”,以避免 AlphaFold 式的软件垄断。
为什么这次大家真的合作了?
原因非常现实:
威胁存在:行业不愿看到 AI 基础设施被一家企业垄断。
成本太高:从零训练一个 AF3 级别的大模型,是十亿级资金的游戏。
于是,联盟得出唯一合理的结论:
结构生物学的基础模型必须成为共享资源。
OpenFold 不是理想主义,而是产业级的经济决策:
把底层工具“商品化”,让竞争回到真正有价值的地方——发现新药。
数据优势被颠覆了
AI 的秘密永远是:谁有数据,谁就赢。在大多数 AI 领域,大型科技公司占优势,因为它们有海量数据。
但在药物研发领域,一个关键事实被很多人忽略:
最重要的数据——高质量、经验证的蛋白-配体结构——大多在药企的私有数据库里。
Google 无法获取这些数据。OpenFold 可以。
Apheris + 联邦学习 = 游戏规则改写
OpenFold 联盟通过 Apheris 的联邦学习框架,让模型在各大药企的内部服务器上训练,数据从未离开公司,一切更新都加密汇总。
最终结果是:OpenFold 模型潜在使用的数据规模,是公共数据库的 5 倍。
更关键的是:这些数据是 真正与药物开发相关的结构,而不是“容易结晶”的结构。
这是 AI 历史上的第一次:开放模型的数据优势超越了闭源模型。
真正的竞争维度——可用 vs. 不可用
行业的核心问题从来不是“开放 vs. 闭源”,
而是:我能否合法、可靠地在自己的数据上运行这个模型?
在可用模型中,目前形成“开放生态双支柱”:OpenFold 3:静态结构预测的基础平台(Apache 2.0).
目标:实现 AlphaFold3 全功能对标,成为合法可商用的结构预测基础设施。
Boltz-2:结构 + 相互作用 + 动态的建模平台(MIT License)
基于分子动力学数据训练,专注解决结构变化、亲和力预测等 “药物研发核心难题”。
两者不是竞争,而是互补。
开放 vs. 闭源 ——不同的创新引擎
开放不是道德高地,闭源也不是落后者。
AI 基础模型依赖数据 ⇒ 需要开放生态才能持续进步。
物理驱动的算法(如量子化学)依赖工程与科学 ⇒ 闭源更具优势。
未来科学生态必然是“两条道路共存”的格局。
平台胜过产品——新生态从“中心辐射式结构”诞生
AF3 是“产品”:你能用它,但不能修改它。
OpenFold 和 Boltz 是“平台”:为行业提供可检查、可扩展、可二次开发的基础层。
在这种“中心–辐射”式(hub-and-spoke)结构中:
OpenFold / Boltz 是“中心”,提供共用能力
各药企基于自己的私有数据微调,形成“专属模型”
核心竞争力从“谁算得更快” → “谁的数据更好”。
这是 AI 生物学的新范式。
开放生态已经开始“跳跃式领先”
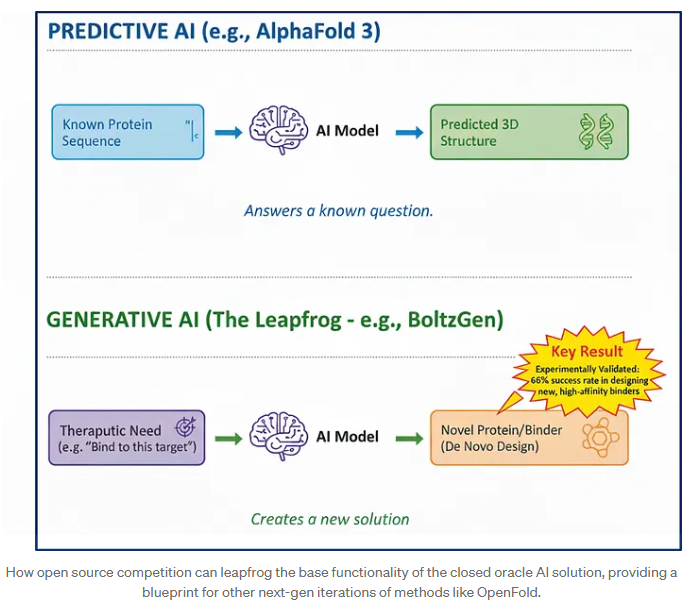
闭源 AF3 的定位始终是“预测模型”。
开放生态却走向了“生成式”未来:
BoltzGen:基于 Boltz 平台的生成式设计模型
它不是预测结构,而是直接设计新型蛋白和肽类药物。
论文报告显示,它成功设计出多种纳摩尔级别亲和力的新型结合物,成功率高达 66%。
这是完全超越“AF3 做不到的事”的新能力。
没有过去的开源生态,就没有今天的 Bio-AI
在 AlphaFold 之前,正是 PyMOL、VMD、JMol 等开源工具让 PDB 的价值不断扩大,使结构生物学逐步积累成 AI 可用的大规模基础数据库。
PyMOL 后来被 Schrödinger 收购,但由于市场压力仍必须维护开源版本——这说明:开源生态不仅推动创新,还决定未来科学家的工具习惯。
未来属于“无许可创新”
Google 选择商业化是完全合理的——商业公司有义务为股东创造价值。
但 AF3 的闭源,也让整个行业意识到:基础层必须开放,否则创新将被束缚在一家公司手中。
OpenFold3 作为“静态结构的守门人”,Boltz-2 作为“动力学与相互作用的先锋”,共同构成未来生物智能的基础平台。
下一次 AlphaFold 级别的突破,很可能不是结构预测——而是蛋白动态的预测。
这是开放生态正在提前布局的领域。
总结:革命的下一阶段由开放推动
DeepMind 与 AlphaFold 的贡献毋庸置疑,它点燃了整个领域。但真正重塑未来的力量,是让整个社区能够:
不是等待答案,而是拥有“提更好问题的能力”。
这就是从“封闭神谕”到“开放平台”的根本区别。
这就是“无许可创新”的力量。
也是生物医药行业真正重夺科学创新未来的方式。
整理 | DrugOne团队
参考资料
https://medium.com/@dapscience/the-great-divergence-why-openfold3-represents-a-new-foundational-platform-for-bio-ai-72fd13b9a774

内容为【DrugOne】公众号原创|转载请注明来源
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢