DRUGONE
CRISPR–Cas系统是强大的基因编辑工具,其活性可通过抗CRISPR蛋白(Acr)进行调控。Acr来源于噬菌体,能够抑制 Cas 蛋白功能。然而,能够有效抑制具有重要生物技术价值的CRISPR系统的Acr数量有限,且天然发现过程缓慢且困难。
为突破这一限制,研究人员提出一种基于从头蛋白设计的快速策略,开发全新自然界不存在的抑制蛋白用于精准控制CRISPR–Cas活性。以Leptotrichia buccalis的Cas13a 系统为代表,研究人员利用人工智能设计出一系列新型抗 CRISPR蛋白(AIcrs),能够对Cas13a核酸酶活性实现高度强效且特异的抑制。研究进一步构建了系统化的设计—验证工作流,并证明这些AIcrs能够在细菌与人类细胞中有效调控CRISPR–Cas13功能,为基因编辑工具的安全可控应用提供了全新解决方案。

CRISPR–Cas技术已广泛应用于基因编辑、分子诊断与合成生物学等领域。然而,Cas蛋白的高活性同时也带来脱靶效应与安全性隐患,因此亟需精确调控工具。
自然界中存在抗CRISPR蛋白,能够通过多种机制抑制Cas蛋白功能,为精准控制基因编辑提供了灵感来源。但目前已发现的Acr数量有限,尤其是针对 RNA 靶向的 Cas13系统,可用抑制蛋白极为稀缺。
传统Acr发现依赖于噬菌体筛选和基因组挖掘,效率低下,难以满足快速拓展需求。与此同时,从头蛋白设计与人工智能模型的进步使得直接创造具备特定功能的新型蛋白成为可能。
基于此,研究人员尝试将AI驱动的蛋白设计方法应用于 Acr开发,探索是否能够“按需设计”高效Cas抑制蛋白。
方法
研究人员构建一套从头蛋白设计流程,结合结构建模、界面优化与深度学习生成模型,针对Cas13a的关键功能区域设计可结合并抑制其活性的新型蛋白结构。随后通过体外生化实验筛选高效候选物,并在细菌系统和哺乳动物细胞中测试其对Cas13活性的调控能力。整个流程实现了从计算设计到功能验证的快速闭环。
结果
构建 AI 驱动的抗 CRISPR 蛋白设计流程
研究人员设计了一套完整工作流,包括:
Cas13a 结构分析与抑制靶点选择
从头生成可结合界面的新蛋白骨架
计算筛选稳定性与结合能力
该流程能够在短时间内产生大量候选抑制蛋白。
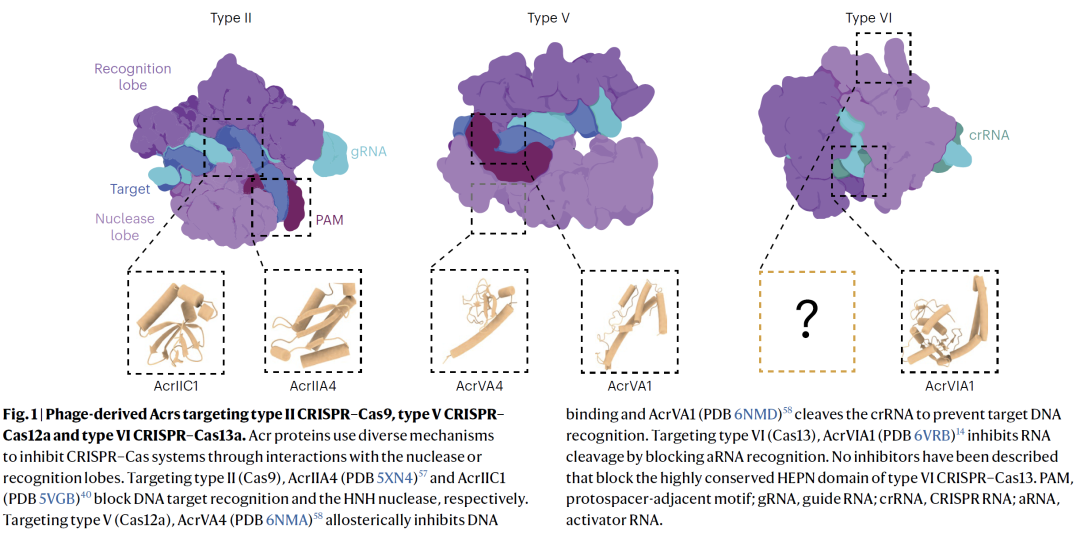
发现多种强效 Cas13a 抑制蛋白
体外实验表明,多种 AIcr 候选蛋白可在低浓度下几乎完全抑制 Cas13a 的 RNA 切割活性,其抑制效率与甚至超过部分天然 Acr。
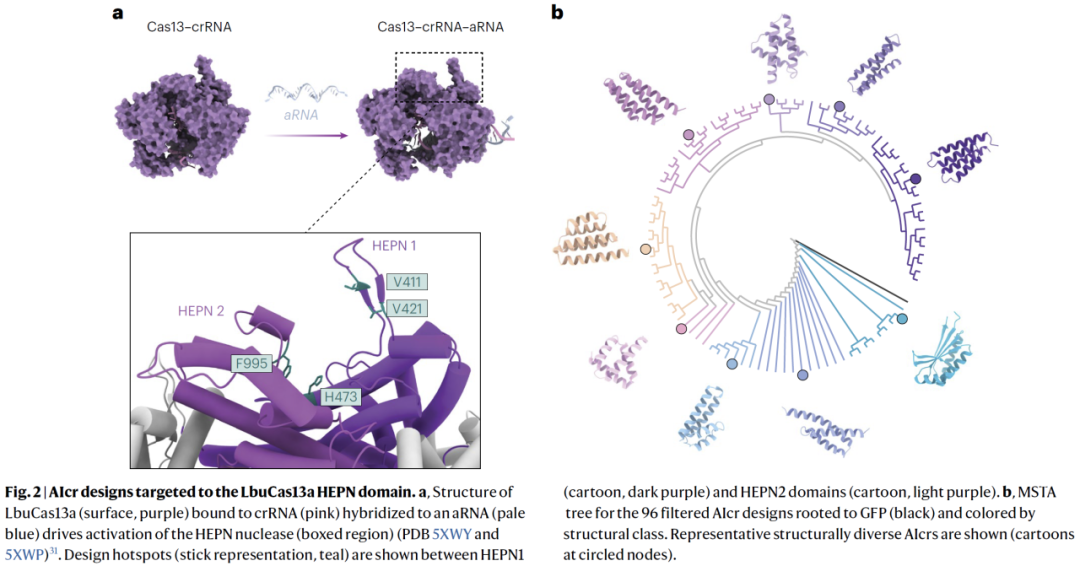
抑制作用具有高度特异性
测试显示,这些 AIcrs 对 Cas13a 具有高度选择性,对其他 Cas 蛋白系统几乎无抑制作用,说明设计过程成功捕捉了 Cas13a 独特结构特征。
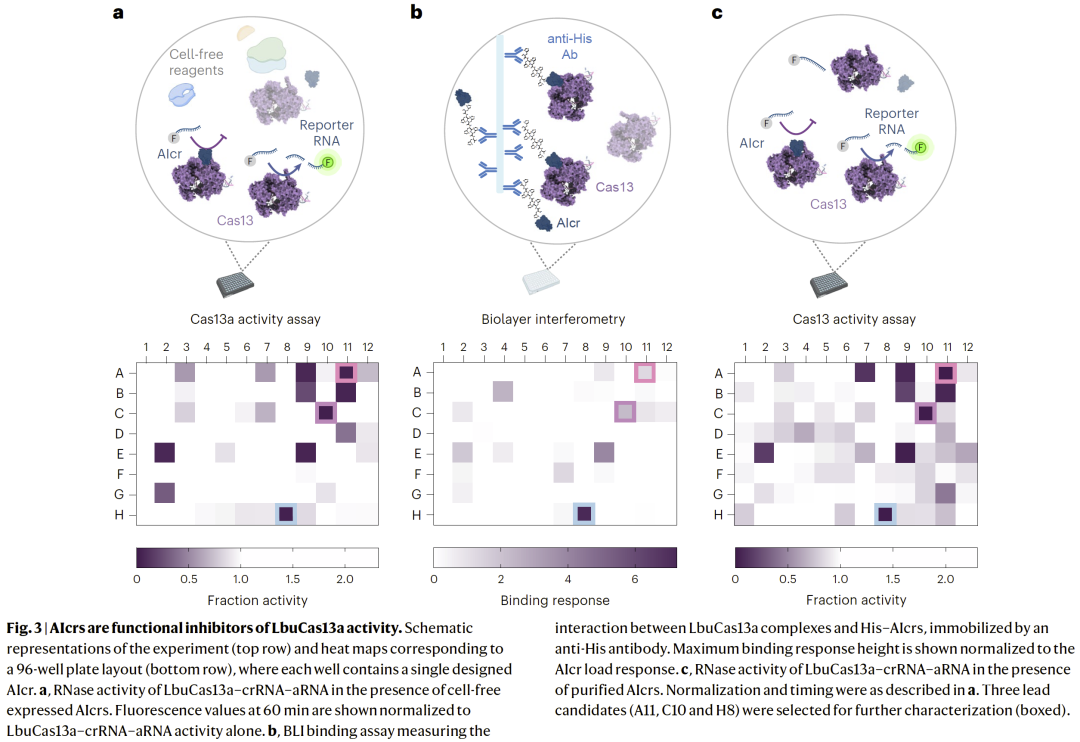
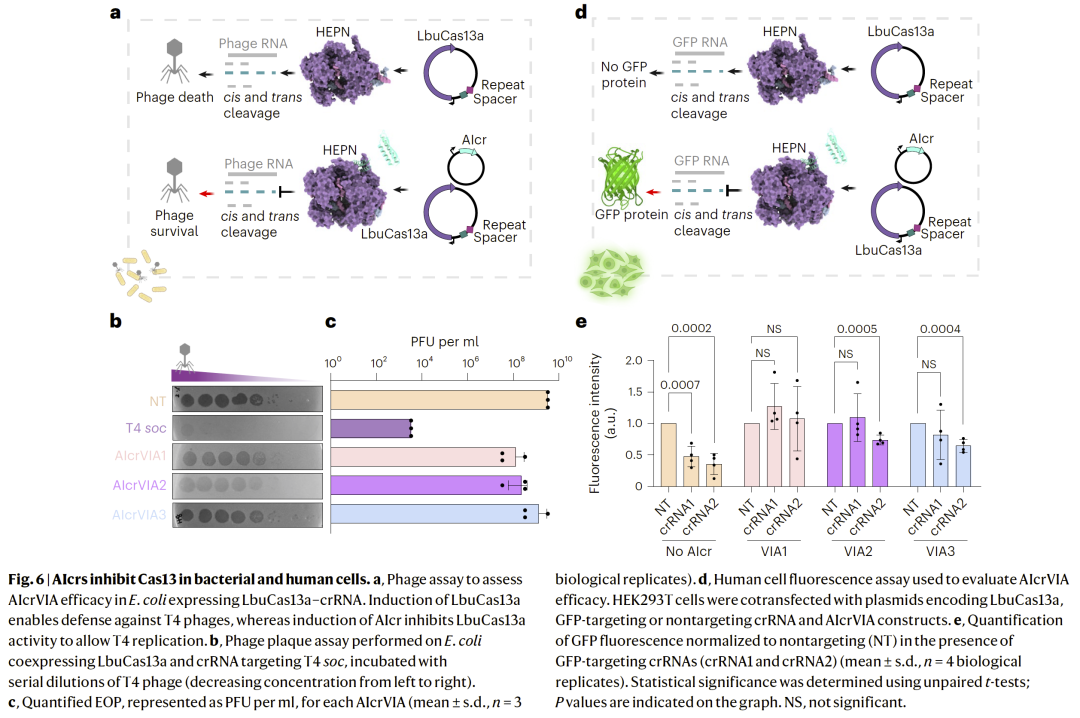
在细菌细胞中有效调控Cas13活性
在细菌模型中表达 AIcr 后,Cas13 介导的 RNA 降解过程显著减弱,验证其在活体系统中的功能有效性。
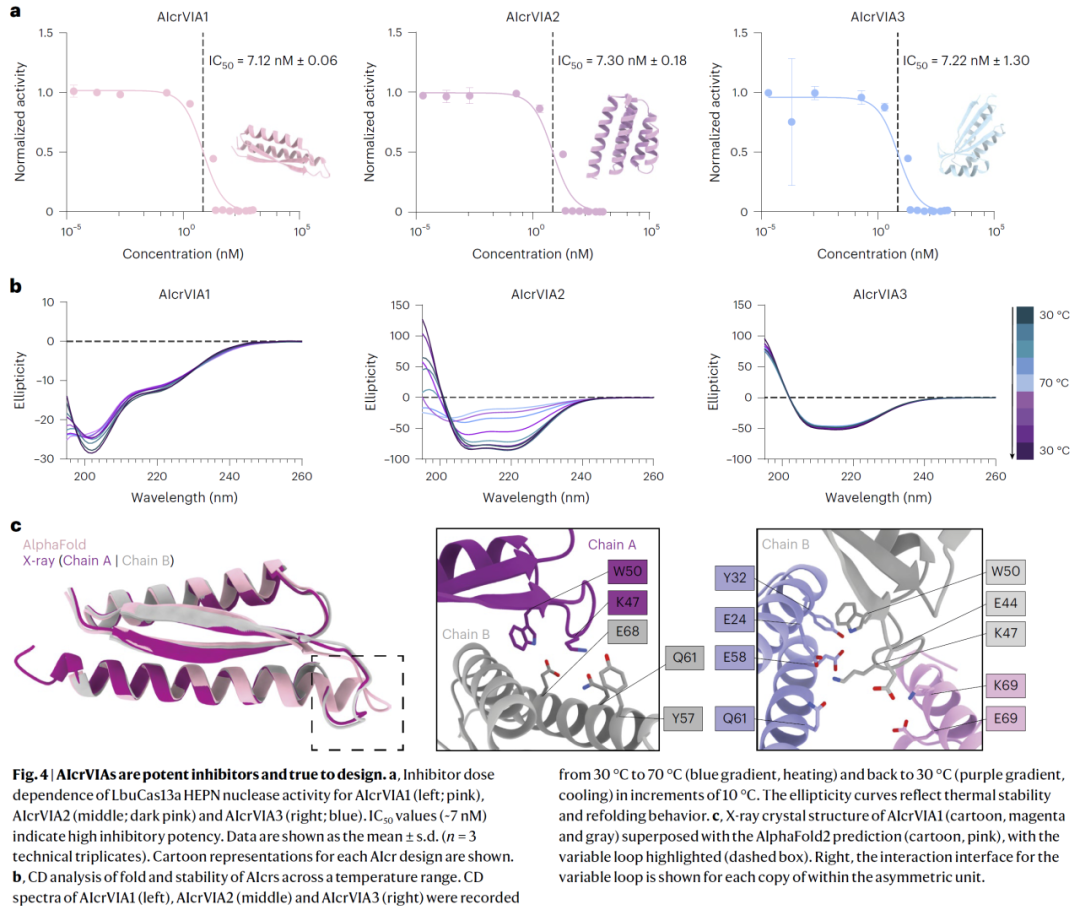
在人类细胞中精准控制Cas13编辑活性
在哺乳动物细胞实验中,AIcrs 能够显著抑制 Cas13 介导的 RNA 编辑或降解过程,同时不影响细胞活性,展示出良好生物相容性。
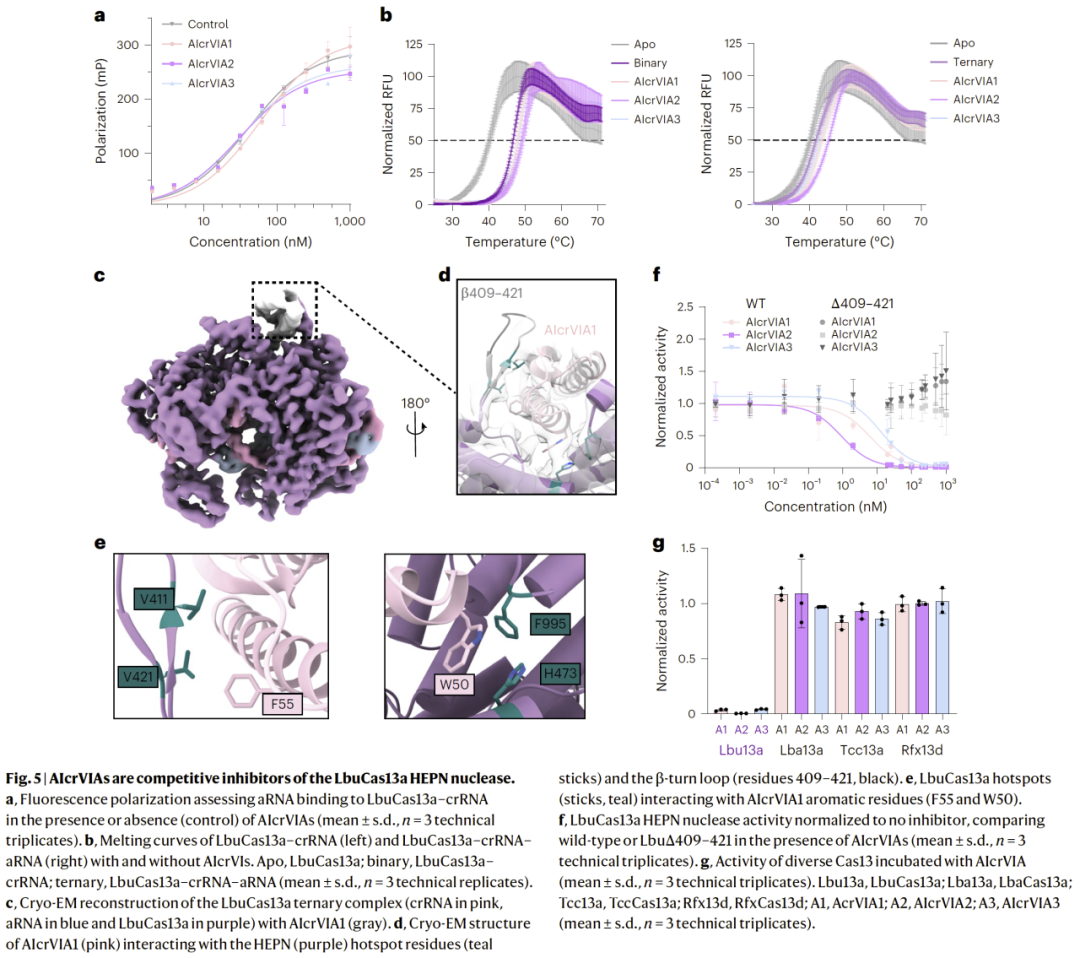
结构分析揭示抑制机制
结构建模与突变分析显示,AIcrs 通过占据 Cas13a 关键功能位点,阻断 RNA 结合或催化构象变化,从而实现高效抑制。
讨论
本研究首次证明了从头蛋白设计可用于构建高效抗 CRISPR 抑制蛋白,突破了传统依赖天然发现的限制。
核心创新在于:
利用人工智能生成新型功能蛋白
实现针对特定 Cas 蛋白的定制化抑制
构建快速设计—验证闭环
这些 AIcrs 不仅具备高效性与特异性,还能够在不同生物系统中稳定发挥作用。
该成果为 CRISPR 技术的安全控制提供了重要工具,并为未来开发可调控基因编辑系统奠定基础。在应用层面,设计型 Acr 可用于:
减少脱靶风险;
实现时序控制编辑;
构建复杂合成生物电路。
研究人员认为,该策略可拓展至其他 Cas 家族成员,甚至用于设计多功能调控蛋白,为可编程生物系统打开新方向。
整理 | DrugOne团队
参考资料
Taveneau, C., Chai, H.X., D’Silva, J. et al. De novo design of potent CRISPR–Cas13 inhibitors. Nat Chem Biol (2026).
https://doi.org/10.1038/s41589-025-02136-3

内容为【DrugOne】公众号原创|转载请注明来源
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢