2021年6月1日,由北京智源人工智能研究院主办的 2021北京智源大会在线上线下同步召开。其中,“AI制药”专题论坛备受关注,首都医科大学附属北京天坛医院院长、神经内科教授王拥军作了题为“人工智能在临床队列研究中的应用”的主旨报告。在报告中,王拥军教授介绍了在临床队列研究中运用人工智能开展新药研发的方法、应用案例和未来研究方向。
王拥军教授介绍到,从上个世纪50年代AI技术出现以来,AI技术真正走进医学界可以分为两个阶段:第一个阶段从2010年至2019年,这期间在医学领域使用最多的是基因组测序、数据挖掘、自然语言处理、机器人外科等;第二个阶段是2019年至今,在这个阶段AI的应用主要是寻找新药靶点、动物研究设计以及个体化医疗等,其中在临床相关领域越来越多地将人工智能、大数据等技术应用于新药靶点的研究。
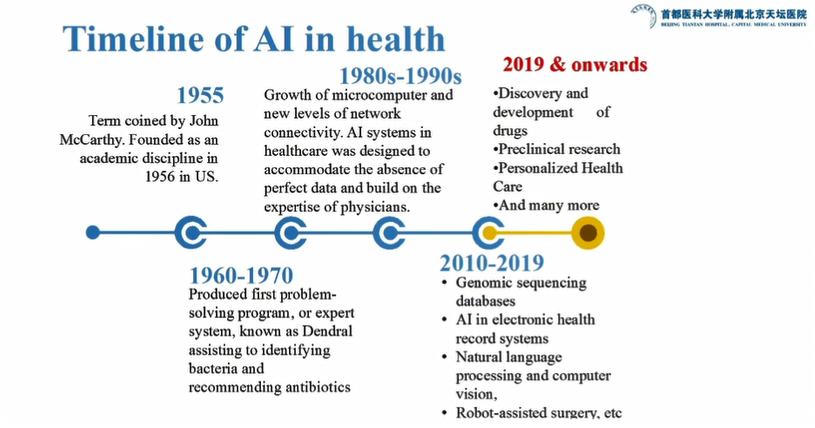
图1:AI在医学领域应用的时间线
王拥军教授介绍了药物研发的历程,从1800年开始研制第一代药物,1910年开始做小分子化合物,一直到2015年新药研发和人工智能相结合,具体包括:AI+药品设计、AI+药理学、AI+化学合成、AI+药物重定位、AI+药物筛选等。此外,各大药厂(如辉瑞、拜耳等)也都开始应用人工智能技术,未来这方面的研发也会越来越深入。
关于如何基于人工智能技术寻找新药靶点,王拥军教授指出传统的转化医学采用从实验室到临床应用(Bench to Bedside)的方式。由于这种方式属于知识驱动型的研究,需要掌握一个分子的生理作用和病理作用之后才能开展实验。
在新药研发中,将人工智能技术和队列技术相结合可有效解决这一问题。目前新兴的药物研发方法采用BBB模型(Bedside-Bench-Bedside Model),主要包括以下步骤:(1)建立涵盖患者血样、尿样、影像学信息的临床队列;(2)测定基因组、蛋白组、代谢组、表观遗传等多组学数据;(3)基于人工智能算法挖掘分子网络与临床现象的相关性,并根据强相关性发现潜在药物干预靶点;(4)在实验室对潜在药物干预靶点进行验证和解读,并从小分子、抗体、基因等方式中寻找靶点干预的方式;(5)在确定靶点干预方式后,开始进行临床前的动物实验;(6)在动物实验有效的前提下开展临床试验和后续的临床实践。
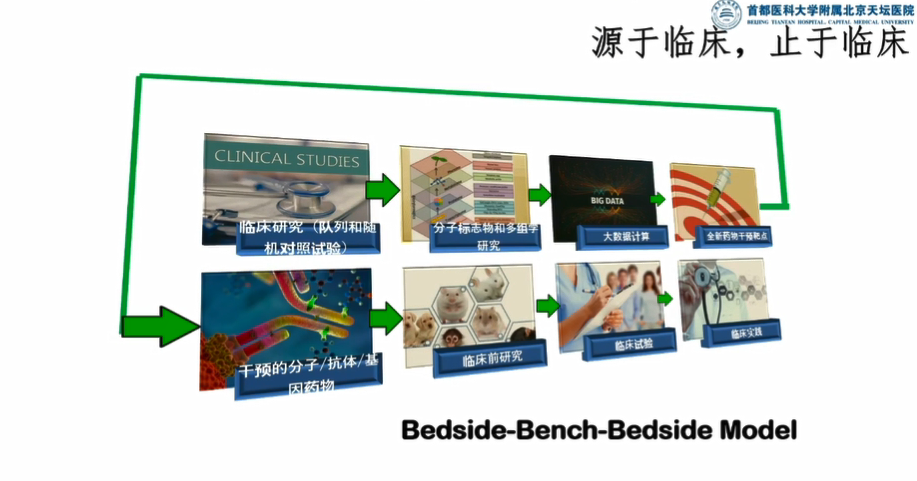
图2:BBB模型的流程
此外,王拥军教授还分享了国外基于人工智能、队列技术研究的成功案例。
Hobbs教授是美国德克萨斯大学西南医学中心教授,霍华德休斯医学研究所研究员,2016年生命科学突破奖的获得者。Hobbs教授长期致力于人类心血管疾病、脂肪肝、糖尿病的治疗及致病机理的研究。1999年,Hobbs教授和她的同事们在达拉斯建立了一个4100人的达拉斯心脑队列,并通过对4100人血液样本测量血糖血脂和外显子基因等,其中在测序了血浆LDL胆固醇水平远低于普通人的128个受试者的PCSK9的编码基因之后,发现了2个无义突变,而这些突变可使得血浆中胆固醇含量降低40%,这证实了PCSK9的功能缺失可以显著降低血中LDL-C水平。
但由于该研究随访时间较短,还不能明确PCSK9突变对心血管疾病风险的影响。于是Hobbs教授又和其他科学家合作,对随访近20年的社区动脉粥样硬化风险研究(ARIC)受试者开展了基因测序和综合分析。2006年发表在《新英格兰医学杂志》上的测序和分析结果震惊了整个心血管圈子:在ARIC研究的3000多名黑人受试者中,2.6%受试者携带了PCSK9功能缺失性突变,他们的LDL-C水平比不携带突变的人低28%。2012年,两个药厂把此靶点用于药物研发,并在新英格兰医学杂志报道了首个将PCSK9单克隆抗体作用于健康志愿者和无家族性高胆固醇血症的受试者LDL胆固醇,血浆中胆固醇含量至少降低一倍,因此可以证实新型降脂药PCSK9单克隆抗体的有效性。这个案例表明应用临床队列方法寻找新药靶点,能够为新药研发提供新的可能。
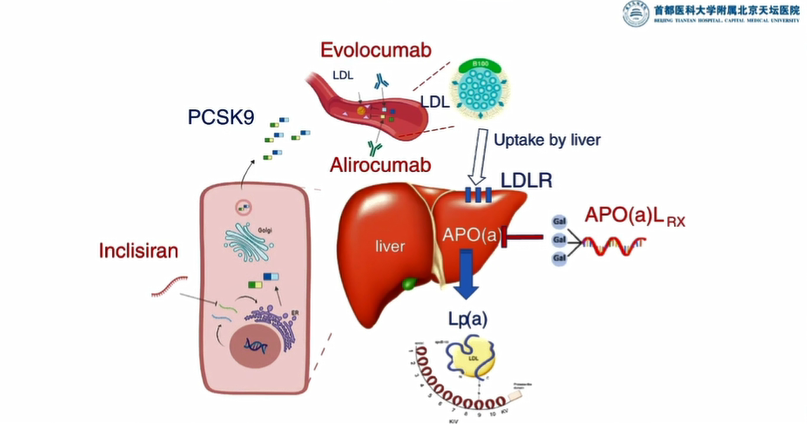
图3:PCSK9单克隆抗体作用机制
对于国内这个方面的研究,王拥军教授也分享了当下他的同事做的一项工作。脑血管疾病是最常见的神经系统疾病,具有发病率高、死亡率高的特点。过去十几年间,国家研究中心一直致力于脑血管病的相关研究,期间遇到最艰难的问题是如何抑制脑血管疾病的复发,降低 致残率和死亡率。尽管我们研究的降压药物能够使脑血管病复发率从27%降低至8%,但仍有部分患者尽管使用了多种药物,效果并不显著,对于这类情况我们称之为疾病的残余风险。所以新药研发的重点是通过人工智能、临床队列以及多组学的结合,达到了解和解决脑血管病残余风险的目的。
目前这项工作具体的开展主要包括如下步骤:
- 建立第三次中国国家卒中登记(The Third China National Stroke Registry, CNSR-III),CNSR-III是全国范围内基于病因、影像学和生物学标志物的缺血性卒中或短暂性脑缺血发作(TIA)登记,旨在阐明缺血性卒中的发病机制和预后因素。2015年8月至2018年3月期间,CNSR-III从中国22个省份和4个直辖市的201家医院中连续招募了缺血性卒中或TIA患者。通过面对面访谈、前瞻性地使用电子数据采集系统等方式收集临床数据。于患者出院后的3个月、6个月及1~5 年对其进行随访,完善临床结局,完成基线脑成像、采集基线血样、检测生物标志物。CNSR-III共计入组15,166例卒中患者,其中7%为女性,平均年龄为62.2±11.3岁,缺血性卒中占比93.3%(n=14,146),TIA占比6.7%(n=1020)。
- 基于采集的数据做多组学的测定。首先做基因组的测序,我们选择30X的测序深度,基本上可以识别90%的基因;然后做表观遗传学、蛋白组、代谢组等的测量。
- 将多组学的数据测定完成之后,开始应用人工智能技术挖掘跨组学信息和临床现象的相关性,若跨组学信息和致残相关,则可能是神经保护的靶点;若跨组学信息和死亡相关,可能是抗水肿的靶点。
- 在找到药物干预的潜在靶点后,开始进行细胞模型和动物模型验证,并做生物学解释。如果具有可解释性,则尝试进行靶点阻断的实验。
因此,此过程是建立临床队列、完成多组学测定,并运用庞大的计算平台和人工智能技术去寻找挖掘跨组学信息的过程。
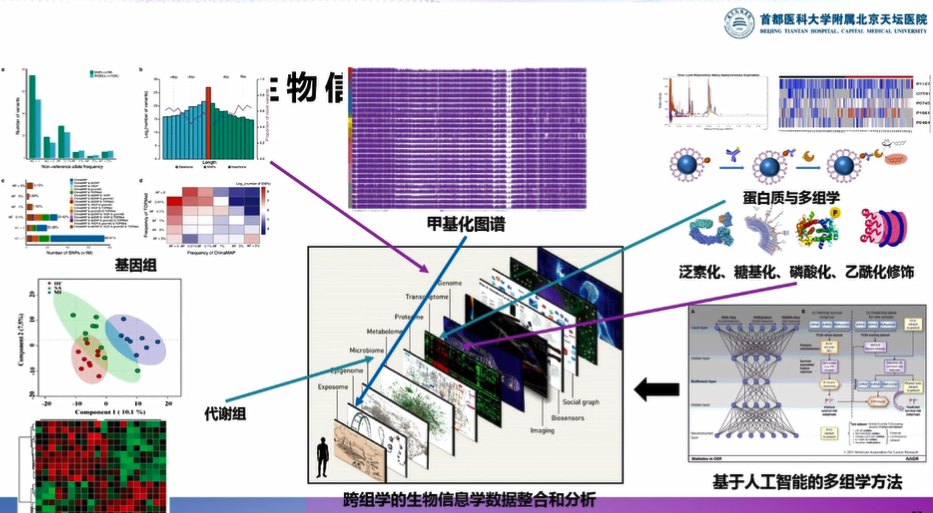
图4:跨组学生物信息学数据整合和分析过程
最后,王拥军教授也指出,为实现此过程应把握以下三个关键的要素:一是高质量的队列;二是以多组学为基础的大数据平台;三是掌握生物信息技术和人工智能技术的团队。为此,
王拥军教授和鲁白教授在2019年成立了一个研究院——北京天琪国际转化医学研究院(简称),这个研究院在今年5月14日被市政府正式批准,成立研究院的目的是想完成新药转化的全链条,从而实现了临床队列、基于多组学的大数据中心、基于人工智能的多组学信息平台、生物学验证、新药研发、临床试验中心全链路的打通。最后,王拥军教授呼吁各团队共同参与,一起利用平台为中国新药研发开辟新的道路。
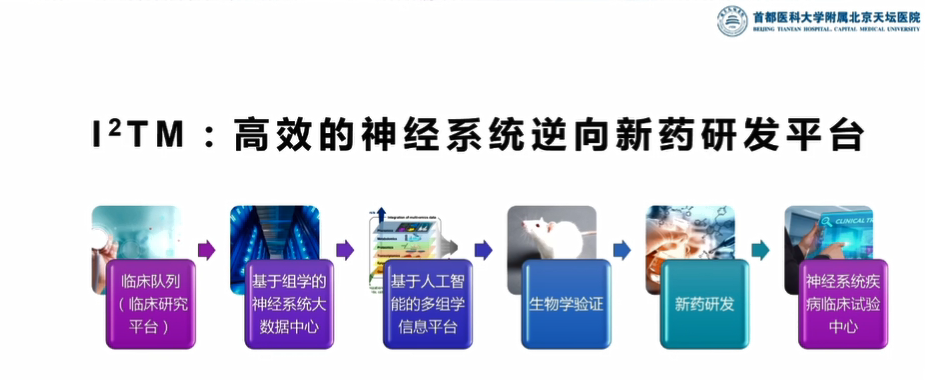
图5:神经系统逆向新药研发平台的主要内容
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢