滑铁卢大学计算机科学系教授,百蓁生物董事长李明做了题为“人工智能赋能个体化癌症免疫治疗”的报告,阐述了用人工智能技术服务癌症免疫化治疗的创新。
据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据显示,2020年全球新发癌症病例1929万例,死亡病例996万例。其中中国新发癌症457万例,占全球的23.7%,死亡病例300万例,均位居全球第一。因此癌症的有效治疗是我国十分严峻的挑战。
癌症的治疗方法通常有手术、化疗、放疗、免疫治疗等。李明教授的主要研究为人工智能在个体化癌症的免疫治疗。人体免疫系统起着保护机体免受引起感染侵害,进行巡视预防癌症的作用。然而有时由于癌细胞与正常细胞的差异不大,免疫系统不会将癌细胞视为外来细胞。癌细胞本身可以释放出可以控制免疫系统的物质,免疫系统虽然能够识别癌细胞,但做出的反应却不足以破坏杀伤癌症细胞。为了克服以上的问题,研究人员找到了帮助免疫系统识别癌细胞并增强其反应能力的方法,从而杀死癌细胞。这就是免疫治疗。
目前基于T细胞的癌症免疫治疗主要有3种方法,即主动接种疫苗、过继细胞转移治疗和免疫检查点阻断。基于新抗原的免疫疗法,尤其是癌症疫苗,需要确定每个患者的靶抗原,因此该方法极大地体现了个性化免疫治疗。这种个性化医疗称为精准医疗,一般适用于分子靶向药物的选择。基于新抗原的癌症疫苗也超越了当前个性化医疗的概念,根据基因组学和蛋白质组学分析个体患者的突变情况,按需为个体患者制造符合其病情的个体化癌症疫苗。
传统的个性化医疗寻求适合该药物的患者亚群,而基于新抗原的癌症疫苗则是为患者量身定制的。在这种情况下,与开发化学和生物药物产品的要求相比,对每个单独的疫苗进行广泛的安全性和有效性测试是不可行的。因此,个性化免疫疗法的开发可能需要从当前适用于常规药物开发的监管框架进行范式转变。新抗原的免疫新疗法面向个性化治疗,在未来十年很有可能彻底改变癌症患者的治疗模式。
基于新抗原的免疫疗法,分为以下步骤:(1)通过活检获取肿瘤DNA;(2)肿瘤细胞的全外显子测序;(3)分析肿瘤细胞的体细胞突变,计算与人类白细胞抗原结合的突变新抗原;(4)合成新抗原并进行免疫注射;(5)检测特意结合新抗原的T细胞数量是否增多,从而确定是否有效。
传统主流的个体化免疫治疗流程中,寻找个体患者有效的新抗原需要在从肿瘤细胞提取的所有多肽段中对照已有的数据库库,筛选出可能的突变新抗原,进而继续后续的治疗。整个过程找到个体患者的有效新抗原需要3个月时间,并且具有花费高,易漏检,准确性差等诸多缺点。在2017年,Nature Biotechnology发起呼吁,传统的质谱法得到的多肽段具有敏感、漏检等缺点,急需一种更加有效的方法来筛选有效新抗原。而在当时,占据多肽从头测序市场70%的百蓁生物,开发突破传统方法的重任,百蓁生物责无旁贷,将该研究作为肩上的使命。李教授的工作专注于通过用人工智能的方法筛选出有效的新抗原。
针对传统基于数据库检索的解析方法在面对蛋白质数据库中未收录蛋白质以及抗体药物测序困难的问题,李教授发表在2017年PNAS上的“De novo peptide sequencing by deep learning”,首次将深度学习用于数据依赖性采集蛋白组学,提出了DeepNovo肽段从头测序框架。DeepNovo采用两组CNN与一组LSTM进行肽段的从头测序,其中两组CNN分别称为spectrum-CNN与ion-CNN,在spectrum-CNN部分中,DeepNovo学习谱图的一般特征,并将其传递到LSTM神经网络中。在ion-CNN部分中,通过学习当前谱图特征,给出预测的氨基酸候选可能。如此,可以得到两组信息,即从ion-CNN学习得到的信息以及经过spectrum-CNN和LSTM后得到的信息,将这两组信息进行整合,可以得到未知肽段的序列预测。经过DeepNovo进行分析后,准确度大幅领先目前已有的从头测序方法。
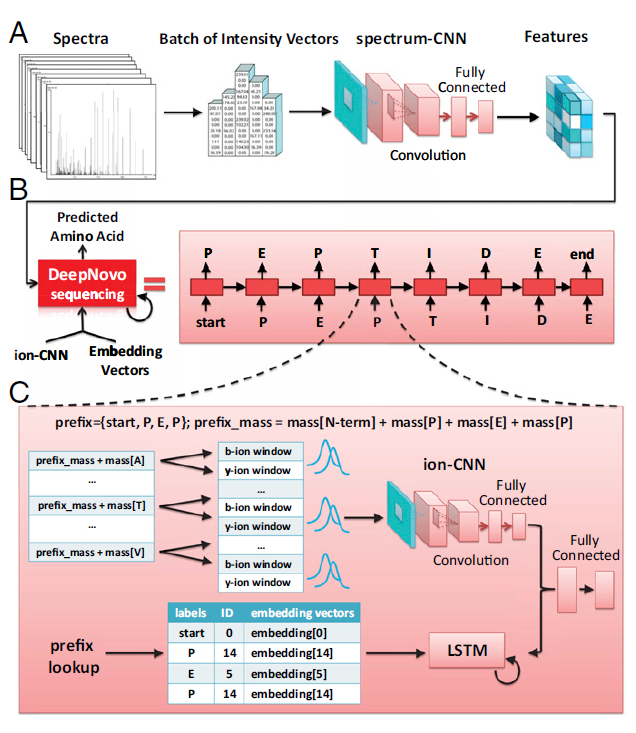
图(1)DeepNovo实现了肽段从头测序
从质谱中从头测序寻找新肽的过程中,测序结果的整体质量取决于从头测序算法以及质谱的质量。随着质谱仪分辨率和准确度的提高,质谱的质量也在同样提升,如何有效地利用高分辨率数据而不大幅增加计算的复杂性仍是从头测序的一个挑战。李教授发表在Nature Machine Intelligence上的文章“Computationally instrument-resolution independent de novo peptide sequencing for high-resolution devices”,提出了PointNovo,将PointNet引入肽段从头测序中,首次不依赖质谱仪精度,稳健地处理任何分辨率的质谱数据同时保持计算复杂度不变。该方法将质谱中的每条数据都有对应的一组核质比和强度值,同样对于理论上所有可能的多肽端也对应一组核质比和强度值,二者作差可以得到实际观测值与理论值之间的差异矩阵,通过非线性变换后将其与原质谱数据融合后作为T-Net的输入,输出对多肽的预测结果。
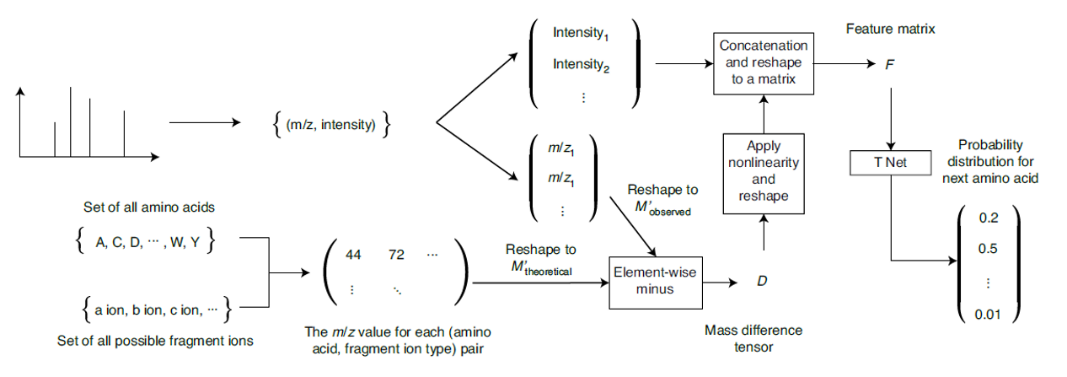
图(2)PointNovo实现了肽段从头测序
传统的方法都是数据依赖采集(Data-Dependent Acquisition,DDA)的肽段从头测序,李教授在DeepNovo的基础上推上更高的层次,实现了基于深度学习的数据非依赖采集(Data-Independent Acquisition,DIA)的肽段从头测序,开发了DeepNovo-DIA模型,该工作“Deep learning enables de novo peptide sequencing from data-independent-acquisition mass spectrometry”发表在Nature Methods上。
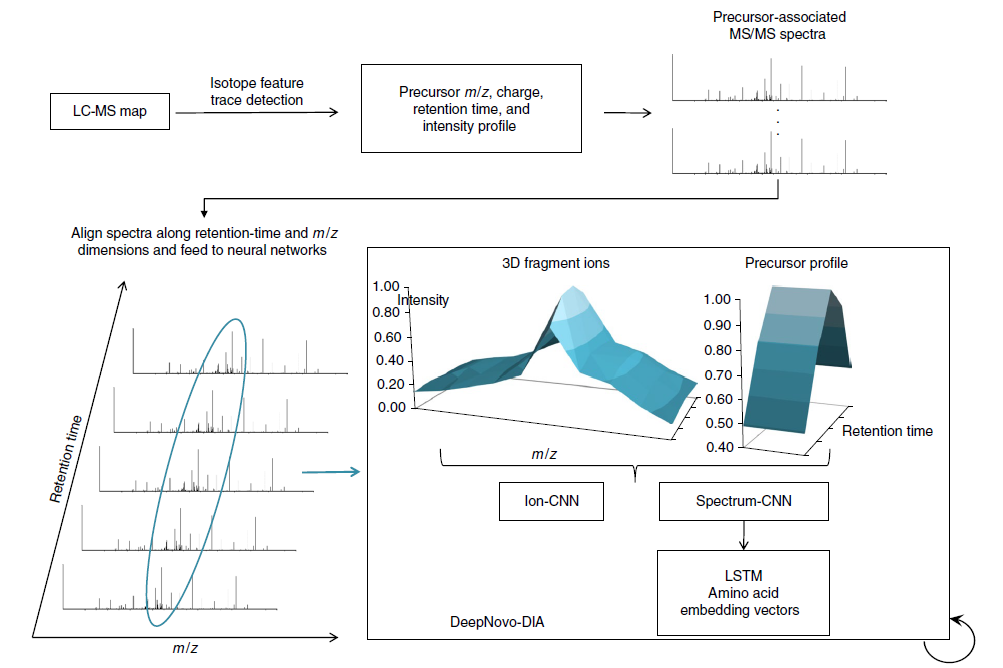 图(3) DeepNovo-DIA实现了非数据依赖的肽段从头测序
图(3) DeepNovo-DIA实现了非数据依赖的肽段从头测序
李教授继续对现有的方法进行推进,提出了一种个体化的肽段从头测序流程,以直接并仅从质谱数据中识别HLA-I和HLA-II新抗原。在个体患者的免疫肽组上训练了个人深度学习模型,然后将其用于预测该患者的突变新抗原。该工作“Personalized deep learning of individual immunopeptidomes to identify neoantigens for cancer vaccines”发表在Nature Machine Intelligence上。
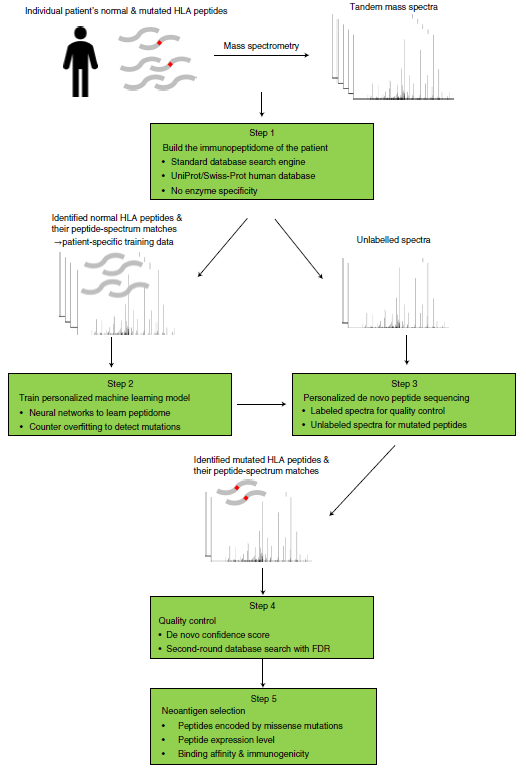
图(4)针对患者的个体化肽段从头预测流程
李明教授团队在基于Neoantigen的免疫治疗方法中进行了丰富的工作,并对新抗原的寻找做出了大量贡献。他们推出了DeepImmu平台,使用人工智能方法替代传统湿实验室过程,仅使用质谱仪即可进行更为准确、快捷且价格更为低廉的抗原表位鉴定。个体化癌症免疫治疗技术通过产生针对个体的特性新抗原而达到准确的治疗目的。使用人工智能技术替代传统的湿实验室也是个体化癌症免疫疗法的必经之路。人工智能赋能个体化免疫治疗方法为精准医疗拉开序幕,其研究与进步也必将为全人类的健康带来更多的福音。
内容中包含的图片若涉及版权问题,请及时与我们联系删除



评论
沙发等你来抢